
| A. | 非自发反应在任何条件下都不能实现 | |
| B. | 自发反应都是熵增大的反应 | |
| C. | 能自发进行的吸热反应一定是熵增大的反应 | |
| D. | 自发反应都是放热反应 |
分析 依据自发进行的反应依据是△H-T△S<0分析判断,反应自发进行取决于焓变、熵变和温度因素的影响.
解答 解:A、非自发反应在一定条件下能实现自发进行,如△H>0,△S>0的反应高温下可以自发进行,低温下反应非自发进行,故A错误;
B、化学反应是否能自发进行,取决于焓变和熵变,不仅仅取决于熵变,故B错误;
C、根据△G=△H-T•△S,如△H>0,则只有△S>0,才能使△G<0,故C正确;
D、化学反应是否能自发进行,取决于焓变和熵变,不仅仅取决于焓变,故D错误;
故选C.
点评 自发反应的判断依据为:△G=△H-T△S,当△G=△H-T△S<0,反应能自发进行;当△G=△H-T△S=0,反应达到平衡状态;当△G=△H-T△S>0,反应不能自发进行.焓变和熵变都不能独立地作为反应自发性的判据,自发反应的判断依据不能判断该反应是吸热还是放热,也不能判断熵的变化.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下将pH=2的硫酸和pH=12的MOH溶液等体积混合,所得溶液pH≤7 | |
| B. | 已知同温度相同浓度的NaNO2溶液比NaF溶液的碱性强,所以氢氟酸的酸性比亚硝酸的弱 | |
| C. | 常温下,将醋酸钠、盐酸两溶液混合后,溶液呈中性,则有c(Na+)>c(Cl-)=c(CH3COOH) | |
| D. | pH相等的NH4Cl、(NH4)2SO4、NH4HSO4三种溶液物质的量浓度为c(NH4Cl)>c((NH4)2SO4)=c(NH4HSO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
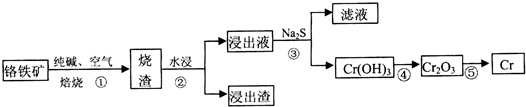 a.操作①中为加热焙烧速率和提高原料的利用率,可采取的措施是将铬铁矿粉碎(答一条即可).
a.操作①中为加热焙烧速率和提高原料的利用率,可采取的措施是将铬铁矿粉碎(答一条即可).| 温度/K | 480 | 505 | 615 | 730 |
| 质量/g | 94.67 | 92.00 | x | 76.00 |
| 化学式 | Cr3O8 | y | CrO2 | Cr2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.15mol/L | C. | 0.2mol/L | D. | 0.25mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 厕所清洁剂、厨房清洁剂、醋、肥皂 | B. | 醋、厕所清洁剂、肥皂、厨房清洁剂 | ||
| C. | 厕所清洁剂、醋、肥皂、厨房清洁剂 | D. | 厨房清洁剂、醋、肥皂、厕所清洁剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
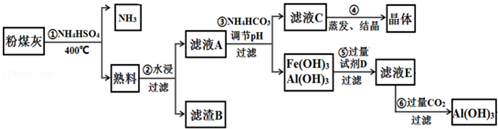
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
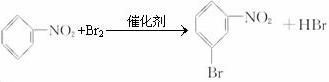 、
、 、
、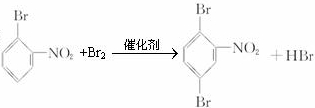 或
或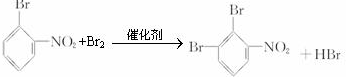 .
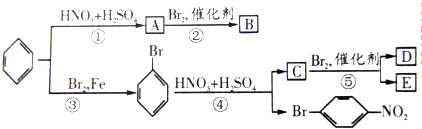
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比为1:6 | |
| B. | 氧化产物与还原产物的质量之比为1:1 | |
| C. | 生成3mol水时有1mol KIO3被氧化 | |
| D. | 1mol KIO3参加反应时有5mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com