
已知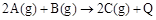 。下列说法或表达正确的是
。下列说法或表达正确的是
| A.使用催化剂可改变该反应的反应热 |
B.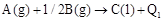 ; ;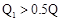 |
C.A和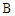 混合气体的稳定性比C气体强 混合气体的稳定性比C气体强 |
| D.该条件下,2LC气体分解成2LA气体与1LB气体吸收的热量为Q |
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:单选题
已知反应:
①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列结论正确的是( )
| A.碳的燃烧热等于110.5 kJ·mol-1 |
| B.2mol C(s)在1 mol O2(g)燃烧,放出221 kJ热量 |
| C.1L0.1 mol/L H2SO4溶液与1L0.1 mol/L NaOH溶液反应,放出5.73 kJ热量 |
| D.pH=3的醋酸与pH=11的NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于反应过程中能量变化的说法正确的是 ( )
| A.图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)ΔH<0使用和未使用催化剂时,反应过程中的能量变化 |
| B.己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2 |
| C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| D.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定条件下,CO和CH4燃烧的热化学方程式分别为:2CO(g)+O2(g) =2CO2(g) H=" -566" kJ/mol,CH4(== CO2(g) + 2H2O(l)
H=" -566" kJ/mol,CH4(== CO2(g) + 2H2O(l)  H=" -890" kJ/mol, 由1molCO和3molCH4组成的混合气体在上述条件下完全燃烧时,释放的热量为
H=" -890" kJ/mol, 由1molCO和3molCH4组成的混合气体在上述条件下完全燃烧时,释放的热量为
| A.2912 kJ | B.2953 kJ | C.3236 kJ | D.3867 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
指常温下,1 mol化学键分解成气态原子所需要的能量用E表示。结合表中信息判断下列说法不正确的是
| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ·mol-1) | 436 | 157 | 568 | 432 | 298 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在压强为2.20×104 kPa、温度达到374℃时,水成为“超临界状态”,此时水可将CO2等含碳化合物转化为有机物,这就是“水热反应”,生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法不正确的是( )
| A.二氧化碳与超临界水作用生成汽油的反应,属于放热反应 |
| B.“水热反应”是一种复杂的物理化学变化 |
| C.火力发电厂可望利用废热,将二氧化碳转变为能源物质 |
| D.随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有关热化学方程式书写与对应表述均正确的是( )
| A.稀硫酸与0.1 mol·L-1NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l) △H =" -57.3" kJ·mol-1 |
| B.在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1, 则水分解的热化学方程式: 2H2O(l)=2H2(g)+O2(g)△H = +285.5 kJ·mol-1 |
| C.已知2C(s)+O2(g)=2CO(g)△H=-221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol-1 |
| D.1mol氢气完全燃烧生成液态水放热为285.8kJ,则氢气燃烧的热化学方程式为 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com