
分析 (1)鉴别KCl溶液和K2CO3的试剂是HCl,碳酸钾和HCl反应生成气体;
(2)根据n=cV计算出硫酸铝的物质的量,然后可得出硫酸根离子的物质的量,最后根据N=nNA计算;
(3)明矾在水溶液中电离生成铝离子、钾离子和硫酸根离子;
(4)采用加热的方法除去碳酸钠中的碳酸氢钠.
解答 解:(1)鉴别KCl溶液和K2CO3的试剂是盐酸,碳酸钾和HCl反应生成气体,离子方程式为:CO32-+2H+=CO2↑+H2O,
故答案为:盐酸;CO32-+2H+=CO2↑+H2O;
(2)100mL 1mol•L-1 Al2(SO4)3溶液中含SO42-离子的物质的量为:1mol/L×3×0.1L=0.3mol,含有硫酸根离子的数目为0.3NA,
故答案为:0.3NA;
(3)明矾在水溶液中电离生成铝离子、钾离子和硫酸根离子,其电离方程式为:KAl(SO4)2=Al3++K++2SO42-,
故答案为:KAl(SO4)2=Al3++K++2SO42-;
(4)碳酸氢钠不稳定,受热易分解生成碳酸钠,所以采用加热的方法除去碳酸钠中的碳酸氢钠,反应方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
点评 本题考查较为综合,涉及物质分离与提纯、离子方程式、化学方程式书写等知识,题目难度中等,明确常见物质性质为解答关键,注意掌握物质分离与提纯原则,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:推断题

 .
.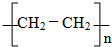 反应类型:加聚反应.
反应类型:加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 工业上用生石灰做脱硫剂 | B. | 氯化铁腐蚀铜刻制印刷电路板 | ||
| C. | 明矾可用做净水剂 | D. | 氢氟酸可用玻璃器皿存放 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
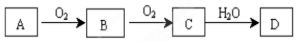
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA | |
| B. | 标况下,11.2L SO3所含的分子数目为0.5 NA | |
| C. | 1molNa2O2溶于水转移的电子数为2NA | |
| D. | 含4 mol HCl的浓盐酸与足量的二氧化锰反应,生成Cl2分子的数目为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A. | 该反应正反应是放热反应 | |
| B. | 该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0 | |
| C. | 在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100 | |
| D. | 工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com