
分析 发生反应:4KO2+2CO2═2K2CO3+3O2,2CO2+2Na2O2=2Na2CO3+O2,利用总质量、生成去氧气推理列方程计算.
解答 解:生成氧气物质的量为:$\frac{1.568L}{22.4L/mol}$=0.07mol,
设KO2和Na2O2的物质的量分别为xmol、ymol,
4KO2+2CO2═2K2CO3+3O2
xmol 0.75xmol
2CO2+2Na2O2=2Na2CO3+O2
ymol 0.5ymol
可得$\left\{\begin{array}{l}{0.75x+0.5y=0.07}\\{71x+78y=7.24}\end{array}\right.$
解得x=0.08,y=0.02
答:KO2的物质的量为0.08mo,Na2O2的物质的量为0.02mol.
点评 本题考查混合物计算,中学不涉及超氧化物的性质,为计算的难点,关键是正确书写化学方程式.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | H2SO4与Ba(OH)2溶液反应,Ba2++OH-+H++SO42-═BaCO4↓+H2O | |
| B. | 实验室用大理石与稀盐酸制取二氧化碳:2H++CO32-═CO2↑+H2O | |
| C. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | Cl2与NaOH溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高反应的温度,会使反应物的活化能迅速降低 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用电解水的方法制取大量氢气可以缓解能源不足的问题 | |
| D. | 推广使用太阳能、风能等能源,有利于缓解温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
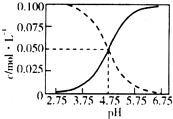 25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )
25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )| A. | 25℃时,CH3COOH的电离常数K的值5×10-2.75 | |
| B. | 随pH增大,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$增大 | |
| C. | pH=4的溶液中,c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | pH=5的溶液中,c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com