
| A. | 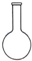 容量瓶 | B. |  萃取瓶 | C. | 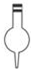 锥形瓶 | D. |  酸式滴定管 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑火药由硫磺、硝石、木炭三种物质按一定比例混合制成 | |
| B. | 炸油条时,常将小苏打和明矾混用做发酵剂 | |
| C. | 大力推广应用燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染 | |
| D. | PM2.5颗粒在大气中可形成气溶胶,具有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
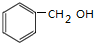
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C | B. | HNO3 | C. | CO2 | D. | SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 3:1 | C. | 1:24 | D. | 24:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
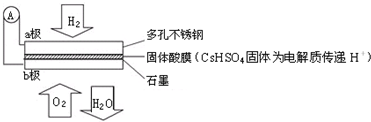
| A. | 电子通过外电路从a极流向b极 | |
| B. | H+由a极通过固体酸电解质传递到b极 | |
| C. | 电池工作时每转移0.1 mol电子,消耗1.12 LH2 | |
| D. | b极上的电极反应式为:O2+4H++4e-=2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
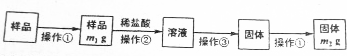
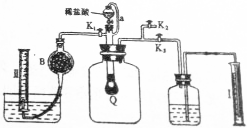
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
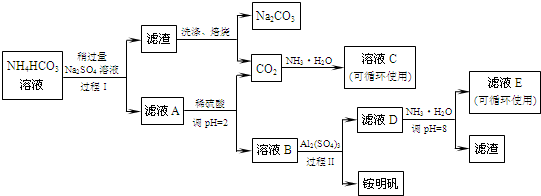
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com