
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:选择题
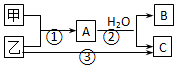
| A. | 若C为酸性气体,则B可能具有两性 | |
| B. | 若C是碱性气体,则B一定是碱 | |
| C. | 若B、C是两种酸,则B、C一定都是一元酸 | |
| D. | 以上3个转变可能都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C与15N有相同的中子数 | B. | 13C的质子数为13 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 25℃时,0.1mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力相当 | |
| D. | 25℃时,将等体积pH=1的盐酸和和水混合,混合后溶液的pH=1.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖和麦芽糖均能发生水解反应和银镜反应 | |
| B. | 植物油可用于萃取碘水中的碘 | |
| C. | 面粉、牛油、丝绸完全燃烧都只生成CO2和H2O | |
| D. | 用渗析的方法不能对鸡蛋白和淀粉的混合溶液进行分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
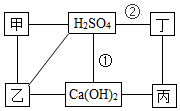 图中每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种,下列说法正确的是( )
图中每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种,下列说法正确的是( )| A. | 甲是Na2CO3 | B. | 乙是Mg | ||
| C. | 反应①②是非氧化还原反应 | D. | 丙与丁发生反应时,丁是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 压强/Mpa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com