
| A.若碳的燃烧热用△H3来表示,则△H3<△H1 |
| B.若碳的燃烧热用△H3来表示,则△H3>△H1 |
| C.稀硫酸与稀NaOH溶液反应的中和热△H=-57.3kJ/mol |
| D.浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
科目:高中化学 来源:不详 题型:单选题
| A.1×10-14 | B.1×10-13 | C.1.32×10-14 | D.1.32×10-15 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HCN | B.CH3COOH | C.HF | D.HNO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.△H1 >△H3 ="-57.3" kJ·mol—1>△H2 |
| B.△H2 <△H1 ="-57.3" kJ·mol—1<△H3 |
| C.△H1 >△H3 >△H2="-57.3" kJ·mol—1 |
| D.△H2 <△H3 ="-57.3" kJ·mol—1<△H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 O2(g)=H2O(l);ΔH="-285" kJ·mol-1
O2(g)=H2O(l);ΔH="-285" kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

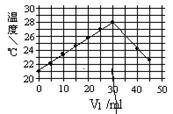
| A.当V1="=30" ml时,盐酸和NaOH溶液恰好完全反应 |
| B.NaOH溶液的浓度约为1.5 mol/L |
| C.做该实验时环境温度为22℃ |
| D.该实验表明化学能可以转化为热能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=7的溶液 |
| B.c(NH4+)=c(Cl-)的NH4Cl和氨水的混合溶液 |
| C.PH=2的CH3COOH和PH=12的NaOH溶液等体积混合 |
| D.CH3COONa溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com