
| A、Al(OH)3滴加稀盐酸:OH-+H+=H2O |
| B、Fe片浸泡在FeCl3溶液中:Fe3++Fe=2Fe2+ |
| C、MgCl2溶液中滴加氨水:Mg2++2OH-=Mg(OH)2↓ |
| D、NaHSO4溶液中加BaCl2溶液:SO42-+Ba2+=BaSO4↓ |


科目:高中化学 来源: 题型:
A、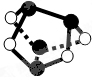 0.5mol雄黄(As4S4,已知As和N同主族,结构如图)含有NA个S-S键 |
| B、用惰性电极电解1 L浓度均为2 mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2 NA个电子转移时,阴极析出6.4g金属 |
| C、1mol过氧化氢分子中共用电子对数为3NA |
| D、0.1mol Na2CO3?10H2O在晶体中或溶液中,含有的CO32-离子均小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4 mol 0.5 mol 0.12 mol |
| B、0.64 mol 0.5 mol 0.24 mol |
| C、0.64 mol 0.02 mol 0.24 mol |
| D、0.66 mol 0.5 mol 0.24 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、发生化学变化则一定伴有能量变化 |
| B、有能量变化则一定发生化学变化 |
| C、1mol碳燃烧所放出的热量一定叫碳的燃烧热 |
| D、物质本身能量越高,该物质越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯的结构简式:C2H4 | ||
B、中子数为20的钾原子:
| ||
| C、次氯酸的结构式:H-O-Cl | ||
| D、氯化钠的分子式为:NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸具有吸水性,可用作干燥剂 |
| B、浓硝酸与铁不反应,可用铁桶贮存浓硝酸 |
| C、硅可作半导体材料,是光导纤维的主要成分 |
| D、SO2能使含有酚酞的NaOH溶液褪色,说明SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B、C、Si和Ge的最外层电子数都是4,次外层电子数都是8 |
| C、若A2+2D-=2A-+D2,则氧化性:A2>D2 |
| D、CO2和SiO2都是酸性氧化物,都不能和氧化钙反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com