
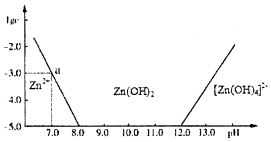
 锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.| C(HCl)/(mol•L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| C(PbCl2)/(mol•L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
分析 (1)①由图象可知溶液的碱性较强时,锌的存在形式为[Zn(OH)4]2-,结合元素守恒书写方程;
②根据图中数据,利用Ksp=c(Zn2+).c2(OH-)计算;
③pH=6时,根据Ksp求出c(Zn2+),再根据反应的锌离子的物质的量计算需要的氢氧化钠的物质的量;
④A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大;
B.沉淀溶解平衡的Ksp随温度变化;
C.PbCl2在浓盐酸中溶解度增大,说明生成了配合物;
D.PbCl2可与Cl-形成配离子;
(2)①在25℃下,将a mol•L-1的NH4Cl溶液与0.01mol•L-1的NaOH溶液等体积混合,反应后测得溶液pH=7,溶液中c(H+)=c(OH-),电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),得到c(NH4+)=c(Cl-),在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$,NH4++H2O?NH3•H2O+H+,Kh=$\frac{c({H}^{+})c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$=$\frac{c({H}^{+})c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$×$\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{Kw}{Kb}$;
②a、溶液中存在电荷守恒,阴阳离子电荷总数相同,电性相反;
b、溶液中存在物料守恒,0.1mo1.L-1的NH4Cl、NH3•H2O溶液等体积混合后,溶液中氯离子物质的量的2倍等于铵根和一水合氨-物质的量总和;
c、混合后得溶液中c(NH4Cl)=0.05 mol•L-1,c(NH3•H2O)=0.05 mol•L-1,溶液呈碱性,说明NH4Cl水解程度小于NH3•H2O的电离程度,抑制水的电离;
d、溶液混合后形成的是缓冲溶液,加入少量酸或碱,溶液酸碱性变化不大.
解答 解:(1)①由图象可知溶液的碱性较强时,锌的存在形式为[Zn(OH)4]2-,所以其反应的离子方程式为:Zn2++4OH-═[Zn(OH)4]2-,
故答案为:Zn2++4OH-═[Zn(OH)4]2-;
②当溶液的pH=7.0时,c(Zn2+)=10-3mol•L-1,Ksp=c(Zn2+).c2(OH-)=10-3•(10-7)2=10-17,
故答案为:10-17;
③往1.00L 1.00mol•L-1 ZnCl2溶液中加入NaOH固体至pH=6,所以溶液中c(OH-)=10-8mol•L-1,则溶液中c(Zn2+)=$\frac{Ksp}{{c}^{2}(O{H}^{-})}$=$\frac{1{0}^{-17}}{(1{0}^{-8})^{2}}$=0.1mol/L,所以反应消耗的Zn2+的物质的量为0.9mol,所以消耗的NaOH为1.8mol,
故答案为:1.80;
④A.根据表中的数据分析可知,随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大,故A错误;
B.PbCl2固体存在沉淀溶解平衡,加少量Cl-平衡逆移,溶解度减小,但溶度积常数随温度变化,温度不变Ksp不变,故B错误;
C.PbCl2在浓盐酸中溶解度增大,说明生成了配合物,所以PbCl2能与浓盐酸反应生成一种难电离的阴离子,故C正确;
D.PbCl2可与Cl-形成配离子,所以PbCl2固体可溶于饱和食盐水,故D正确;
故答案为:C D;
(2)①在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{1{0}^{-7}×0.005}{0.5a-0.005}$=$\frac{1{0}^{-9}}{a-0.01}$,NH4++H2O?NH3•H2O+H+,Kh=$\frac{c({H}^{+})c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$=$\frac{c({H}^{+})c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$×$\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{Kw}{Kb}$=$\frac{1{0}^{-14}}{\frac{1{0}^{-9}}{a-0.01}}$=10-5(a-0.01),
故答案为:10-5(a-0.01);
②a.此溶液一定有电荷守恒,c(NH4+)+c(H+)=c(OH-)+c(Cl-),故a正确;
b.溶液中存在物料守恒,0.1mo1.L-1的NH4Cl、NH3•H2O溶液等体积混合后,溶液中氯离子物质的量的2倍等于铵根和一水合氨-物质的量总和,一定有2c(C1-)=c(NH3•H2O)+c(NH4+),故b错误;
c.混合后得溶液中c(NH4Cl)=0.05 mol•L-1,c(NH3•H2O)=0.05 mol•L-1,溶液呈碱性,说明NH4Cl水解程度小于NH3•H2O的电离程度,抑制水的电离,混合溶液中水的电离程度小于该温度下纯水的电离程度,故c错误;
d.若25℃时将0.1mo1.L-1的NH4Cl、NH3•H2O溶液等体积混合后形成缓冲溶液,此溶液加入少量氢氧化钠抑制电离,促进水解,加入盐酸抑制水解促进电离,溶液酸碱性变化不大,所以溶液的pH变化不大,故d正确;
故答案为:bc.
点评 本题考查了难溶电解质的溶解平衡、酸碱混合溶液定性判断、电离平衡常数的计算,注意对图象和表格中的数据的分析,明确弱电解质电离特点及电解质浓度与其pH的关系是解本题关键,再结合电荷守恒、物料守恒来分析解答,试题培养了学生的灵活应用能力,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+ )=c(OH- )+c(A- ) | |
| B. | 25℃时,pH=4.7浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液中:(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) | |
| C. | 氢硫酸的酸性比碳酸弱,则NaHS溶液中:c(Na+)>c(HS-)>c(H+)>c(OH-) | |
| D. | ①0.2mol•L-1NH4Cl溶液②0.1mol•L-1(NH4)2Fe(SO4)2溶液③0.2mol•L-1NH4HSO4溶液④0.1mol•L-1(NH4)2CO3溶液中,c(NH4+ )大小:③>②>①>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 3 | 10 | 12 |
| n(CO)/mol | 2 | 1 | 0.5 | 0.5 |
| n(CH3OH)/mol | 0 | 1 | 1.5 | 1.5 |
| A. | 在0~3min内,用H2表示的平均反应速率为0.33mol•L-1•min-1 | |
| B. | 在该条件下,上述反应的平衡常数为3 | |
| C. | 反应达平衡时,CH3OH (g)的体积分数为50% | |
| D. | 要增大反应速率且增大 CH3OH (g)在混合物中的体积分数,可采用压缩体积,增大体系压强的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将电石与水反应产生的气体先通入CuSO4溶液再通入酸性KMnO4溶液中,溶液褪色说明有乙炔生成 | |
| B. | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色气体,说明该钾盐是K2CO3或K2SO3 | |
| C. | 将浓硫酸和乙醇溶液共热产生的气体干燥后通入溴的四氯化碳溶液,溶液褪色,说明有乙烯生成 | |
| D. | 将苯、液溴、铁粉混合物反应产生的气体通入到AgNO3溶液中有淡黄色沉淀产生,不能说明有HBr生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 5:3 | C. | 33:11 | D. | 11:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
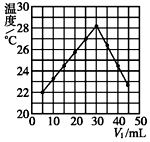 将V1 mL 1.0mol•L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50,溶液混前温度为21℃).下列叙述正确的是( )
将V1 mL 1.0mol•L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50,溶液混前温度为21℃).下列叙述正确的是( )| A. | 该实验表明所有化学反应化学能只转化为热能 | |
| B. | NaOH溶液的浓度为1.0mol•L-1 | |
| C. | 该实验提供的数据能粗略计算出中和热 | |
| D. | 该实验可分多次把NaOH溶液倒入盛有盐酸的小烧杯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
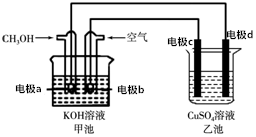 用该装置进行粗铜精炼,粗铜中一般含有锌、铁、银、金等杂质(此题中不考虑其他杂质)在如图所示的装置中,接通电路一段时间后,其中一个电极质量增加了3.2g,在此过程中,下列说法正确的是( )
用该装置进行粗铜精炼,粗铜中一般含有锌、铁、银、金等杂质(此题中不考虑其他杂质)在如图所示的装置中,接通电路一段时间后,其中一个电极质量增加了3.2g,在此过程中,下列说法正确的是( )| A. | 甲池化学能转化为电能,工作时OH-由a→b定向移动 | |
| B. | 通电时,整个电路中电流方向为b→c,d→a | |
| C. | 乙池中CuSO4溶液的浓度不变 | |
| D. | 电极d是纯铜,此过程中电子转移0.05mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鸡蛋清溶于水所得澄清液体无丁达尔现象 | |
| B. | 棉、麻、丝、毛完全燃烧都只生成CO2和H2O | |
| C. | 中国瓷器闻名世界,陶瓷的主要成分是SiO2 | |
| D. | 人体内的酶通常通过降低反应的活化能来加快对应反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com