
| A. |  如图表示ⅥA族元素的氢化物的沸点 | |
| B. |  如图表示ⅦA族元素的熔点 | |
| C. |  如图表示Na+、Mg2+、Al3+的半径 | |
| D. |  如图表示第三周期元素的单质的熔点 |
分析 A、ⅥA族元素的氢化物的沸点随着分子量的增加而增大,水分子之间有氢键;
B、ⅦA族元素的熔点随着原子序数的增加而逐渐增大;
C、Na+、Mg2+、Al3+的核外电子数一样,质子数越多,半径越小;
D、第三周期元素的单质从固体到气体物质,非金属单质的熔点逐渐降低,金属的逐渐升高.
解答 解:A、ⅥA族元素的氢化物的沸点随着分子量的增加而增大,但是水分子之间有氢键,所以沸点最高,故A错误;
B、ⅦA族元素的熔点随着原子序数的增加而逐渐增大,不是逐渐减小的,故B错误;
C、Na+、Mg2+、Al3+的核外电子数一样,质子数越多,半径越小,所以半径顺序是逐渐减小,故C错误;
D、第三周期元素的单质从固体到气体物质,非金属单质的熔点逐渐降低,金属Na、Mg、Al的逐渐升高,故D正确.
故选D.
点评 本题考查原子结构和元素性质,侧重考查元素周期律,熟练掌握同一周期、同一主族元素性质变化规律,并灵活运用这些规律解题,注意规律中的异常现象.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
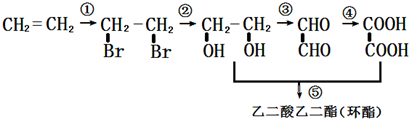
 ;
; +H2O,;
+H2O,; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | HNO3 | C. | Na2O2 | D. | H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
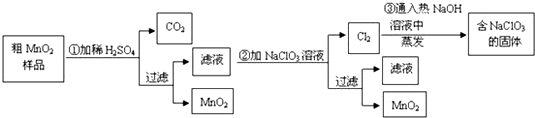
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al (Fe):浓硝酸 | B. | MgO(Al2O3):盐酸 | ||
| C. | FeCl3(FeCl2):氯水 | D. | FeCl2(CuCl2):氢氧化氢钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用化学反应原理解决下列问题.
利用化学反应原理解决下列问题. △H=+124kJ•mol-1
△H=+124kJ•mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com