
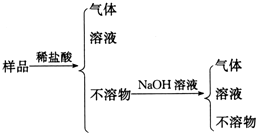
| A. | Al、Cu、Mg、Si | B. | Al、Mg、Si、Zn | C. | Al、Fe、C、Cu | D. | Al、Si、Zn、Na |
分析 金属和酸溶液反应生成氢气,则比含有活泼性较强的金属,由于Si+2NaOH+H2O═Na2SiO3+2H2↑,所以在不溶物中加入过量的氢氧化钠溶液由气体生成,可推测有硅存在,最后剩余不溶物,则一定存在与盐酸、氢氧化钠都不反应的金属,以此解答该题.
解答 解:A.样品中加入过量稀盐酸时,铝、镁完全和稀盐酸反应,铜、硅不能和稀盐酸反应,加入过量氢氧化钠溶液时,硅和氢氧化钠反应,而铜不能和氢氧化钠反应,故A正确;
B.加入过量稀盐酸时,铝、镁和锌和稀盐酸完全反应,加入过量氢氧化钠溶液时,硅和氢氧化钠反应,没有不溶物,故B错误;
C.样品中加入过量稀盐酸时,铝、铁和稀盐酸完全反应,加入过量氢氧化钠溶液时,碳和铜不能和氢氧化钠反应,故C错误;
D.样品中加入过量稀盐酸时,铝、镁、锌和铁和稀盐酸完全反应,故D错误.
故选:A.
点评 本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力的考查,主要考查了对金属活动性顺序的应用,从而培养学生对金属活动性顺序的理解,难度不大.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 理论上任何自发的氧化还原反应都可以设计成原电池.现使用锌电极、铜电极、橙子(酸性介质)设计如图所示的水果电池.
理论上任何自发的氧化还原反应都可以设计成原电池.现使用锌电极、铜电极、橙子(酸性介质)设计如图所示的水果电池.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
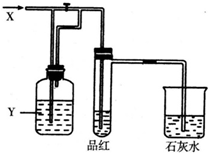 如图所示是一套检验气体性质的实验装置.向装置中缓慢加入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红褪色.据此判断气体X和洗气瓶内溶液Y分别可能为( )
如图所示是一套检验气体性质的实验装置.向装置中缓慢加入气体X,若关闭活塞,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞,则品红褪色.据此判断气体X和洗气瓶内溶液Y分别可能为( )| ① | ② | ③ | ④ | |
| X | SO2 | H2S | CO2 | Cl2 |
| Y | 饱和的NaHCO3溶液 | 浓硫酸 | Na2SO3溶液 | Na2CO3溶液 |
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
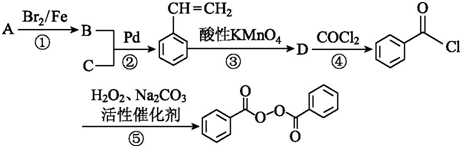
 ;
;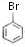 +CH2=CH2$\stackrel{Pd}{→}$
+CH2=CH2$\stackrel{Pd}{→}$ +HBr;
+HBr;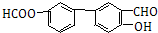 (苯环上基团位置可换);
(苯环上基团位置可换); )
)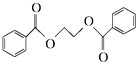 的流程图,无机物任选,注明反应条件.
的流程图,无机物任选,注明反应条件.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子由锌经外电路流向氧化银 | |
| B. | 该电池可实现化学能和电能的相互转化 | |
| C. | 锌是负极,氧化银是正极 | |
| D. | 工作时,负极区溶液pH减小,正极区pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
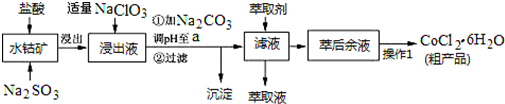
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
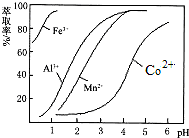
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
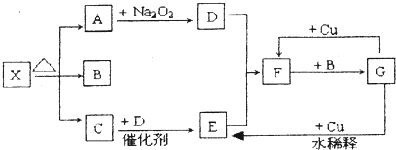
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com