
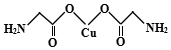
 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备: .
.分析 (1)铜是29号元素,二价铜离子核外有27个电子,根据构造原理写出其核外电子排布式,并确定其外围电子排布式;根据元素周期律比较电第一电离能;
(2)根据价层电子对互斥理论确定其空间构型;
(3)可以根据晶体类型来判断熔点的高低
(4)由氨基乙酸铜中碳原子的价层电子数分别为4,3,来确定其杂化方式;
(5)Cu中心原子,NH3是配体,确定其结构式;
(6)在[Fe(CN)6]4- 中,一个 CN-中含有1个?键,2个π键,且每个CN-和Fe间以配位键相结合;
(7)NaCl晶胞为面心立方密堆积,则晶胞的边长为(2a+2b)pm,计算出Na+和Cl-所占体积和晶胞体积,从而计算出空间利用率.
解答 解:(1)铜是29号元素,二价铜离子核外有27个电子,根据构造原理知,其核外电子排布式为:[Ar]3d9所以外围电子排布为3d9,同一周期中,元素的第一电离能随着原子序数的增大而增大,但第VA族元素的第一电离能大于其相邻元素,所以C、N、O元素第一电离能为C<O<N,
故答案为:3d9;C<O<N;
(2)PO43-中P原子的价层电子对=4+$\frac{1}{2}$(5+3-4×2)=4,P原子为sp3杂化,且不含孤电子对,所以其空间构型正四面体,
故答案为:正四面体;
(3)硫酸铜晶体熔点小于干冰,因为硫酸铜晶体是离子晶体,干冰是分子晶体,离子晶体熔点高于分子晶体,
故答案为:硫酸铜晶体熔点小于干冰,因为硫酸铜晶体是离子晶体,干冰是分子晶体,离子晶体熔点高于分子晶体;
(4)氨基乙酸铜的分子中,当中有一种碳有碳氧双键,即价层电子数为3,所以碳的杂化方式为sp2杂化,另一种碳周围都是单键,即价层电子数为4,故碳的杂化方式为sp3杂化,
故答案为:sp3、sp2;
(5)因为Cu中心原子,NH3是配体,所以确其结构式为 ,故答案为:
,故答案为: ;
;
(6)在[Fe(CN)6]4- 中,一个 CN-中含有1个?键,2个π键,C和N是不同的原子所以为极性键,且之间为每个CN-和Fe间以配位键相结合,
故答案为:B
(7)晶胞中共含有4个Na+和4个和4个Cl-,体积为$\frac{4}{3}$π(a3+b3)×4,晶胞的边长为2a+2b,晶胞体积为(2a+2b)3,氯化钠晶体中离子的空间利用率为:$\frac{\frac{4}{3}π({a}^{3}+{b}^{3})×4}{(2a+2b)^{3}}$=$\frac{2π({a}^{3}+{b}^{3})}{(a+b)^{3}}$,故答案为:$\frac{2π({a}^{3}+{b}^{3})}{(a+b)^{3}}$.
点评 本题覆盖考点知识容量大,主要考查了核外电子排布、电离能、电负性的判断、原子杂化方式、分子空间构型及晶胞的计算以及配位化合物结构式的书写等内容,综合性强,此题难度较大.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
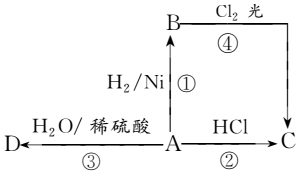 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖、油脂、蛋白质都可以生水解反应 | |
| B. | 天然纤维、聚酚纤维、光导纤维都属于有机高分子材料 | |
| C. | 大力实施矿物燃料脱硫、脱硝技术以减少硫、氮氧化物排放 | |
| D. | 镀锌铁或镀锡铁镀层破损后仍将通过牺牲阳极的阴极保护法防止腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 常温下,NH4Cl溶液加水稀释,$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$增大 | |
| C. | 0.1 mol•L-1NaCN溶液中含 HCN和CN-总数目为0.1×6.02×1023 | |
| D. | FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn片是正极,Cu片是负极 | B. | 电流方向是从Zn经外电路流向Cu | ||
| C. | 电解液的PH保持不变 | D. | Cu片上有气泡产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com