
【题目】下列有关物质用途的说法,不正确的是( )
A. 过氧化钠可用于潜水艇的氧气来源 B. 氯气可用于制农药 C. 纯碱可用于治疗胃酸过多 D. 钠可用于冶炼金属钛
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】姜黄素具有搞突变和预防肿瘤的作用,其合成路线如下:
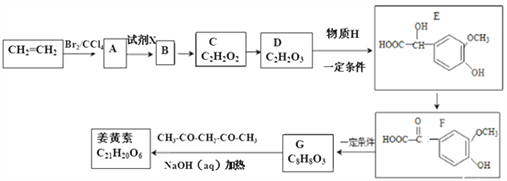
已知:①![]()
②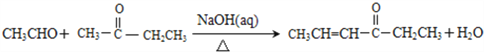
请回答下列问题:
(1)D中含有的官能团名称是___________。
(2)反应A→B的反应条件为________;已知D→E转化中原子利用率100%,则H的结构简式为______________。
(3)姜黄素的结构简式为_________________。
(4)D的催化氧化产物与B可以反应生成一种高分子化合物,其化学方程式为_________________________________________。
(5)下列有关E的叙述不正确的是___________(填正确答案编号)。
a.1molE与浓溴水反应最多消耗3mol的Br2
b.E能发生氧化、加成、取代和缩聚反应
c.1molE最多能与3molNaOH发生反应
d. E能与FeCl3溶液发生显色反应
(6)G(C8H8O3)的同分异构体中,符合下列条件的共有__________种。
①苯环上的一取代物只有2种;②1mol该物质与烧碱溶液反应,最多消耗3molNaOH.
其中核磁共振氢谱中有4组吸收峰的同分异构体的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
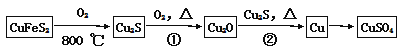
(1)基态硫原子的外围电子排布式为 ,硫元素与氧元素相比,第一电离能较大的元素是 (填元素符号)。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是 ,其立体结构是 。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液![]() 蓝色沉淀
蓝色沉淀![]() 沉淀溶解,得到深蓝色透明溶液,写出蓝色沉淀溶于氨水的离子方程式 ;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
沉淀溶解,得到深蓝色透明溶液,写出蓝色沉淀溶于氨水的离子方程式 ;深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有 。
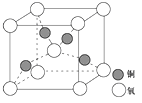
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为 ;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为 pm(用含d和NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同状况下的12C18O和14N2两种气体,下列说法正确的是
A. 若分子数相等,则体积相等 B. 若原子数相等,则中子数相等
C. 若质量相等,则质子数相等 D. 若体积相等,则质量数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用锌与稀硫酸反应制取H2,欲使产生H2的速率加快,下列措施可行的是( )
A.加水稀释B.加少量NaOH溶液C.降低温度D.锌片改为锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016新课标Ⅱ节选]联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为_____________,其中氮的化合价为____________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为_____________________。
(3)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=________________,联氨和N2O4可作为火箭推进剂的主要原因为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如下:

下列有关推断不正确的是( )
A. 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42-
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl-
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100 mL产生的气体A为44.8 mL(标况)则X中c(Fe2+)=0.06 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能光电池由于具有可靠性高、寿命长等特点,适于很多特殊环境和场合,现已得到广泛应用。氮化镓(GaN)光电池的结构如图所示。下列说法中正确的是

A.离子交换膜为质子交换膜,H+从右池移向左池
B.Cu电极上的电极反应为:CO2 + 8e + 8H+![]() CH4 + 2H2O
CH4 + 2H2O
C.该装置系统中只存在两种能量转化
D.常温下,当装置中有1 mol CH4生成时,GaN电极有44.8 L O2生成(不考虑O2的溶解性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有硫酸镁溶液500 mL,它的密度是1.20 g·cm-3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是( )
A. 溶质的质量分数是24% B. 硫酸根离子的质量是230.4 g
C. 溶质和溶剂的物质的量之比约为1∶21.1 D. 溶质的物质的量浓度是2.4 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com