
| A. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO42-+4H2O | |
| C. | 充电时,蓄电池的负极应与外接电源正极相连 | |
| D. | 放电时负极附近溶液的碱性减弱 |
分析 根据电池的总反应可知,高铁电池放电时,锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,高铁酸钾在正极得到电子,电极反应式为FeO42+4H2O+3e-=Fe(OH)3+5OH-,充电时,阳极上氢氧化铁转化成高铁酸钠,电极反应式为Fe(OH)3+5OH-=FeO42+4H2O+3e-,阳极消耗OH-离子,碱性要减弱,阴极上电极反应式为Zn(OH)2+2e-=Zn+2OH-,生成氢氧根离子,所以阴极附近碱性增强.
解答 解:A.根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,故A正确;
B.充电时阳极发生Fe(OH)3失电子的氧化反应,即反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O,故B正确;
C.充电时,蓄电池的负极应与外接电源负极相连,故C错误;
D.放电时,锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,所以负极附近溶液的碱性减弱,故D正确.
故选C.
点评 本题主要考查了原电池和电解池原理的应用,侧重于考查学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力,题目难度中等.


科目:高中化学 来源: 题型:实验题
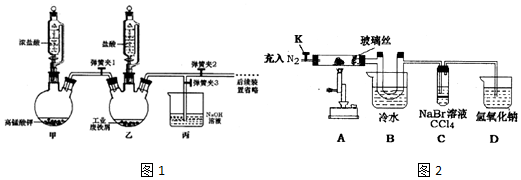
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K,充入氮气 | D中有气泡产生 | ①充入N2的原因排出装置内的空气 |
| 关闭K,加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因FeC13易升华 |
| 实验结束,振荡C静置 | ③溶液分层,上层接近无色,下层橙红色 | ④2FeC13$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl2+Cl2,2Br-+Cl2=Br2+2Cl-(用相关的方程式说明) |
| ⑤结合以上实验和文献资料,该固体可以确定的成分有FeC13、Fe2O3. | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体通过盛有酸性高锰酸钾溶液的洗气瓶 | |
| B. | 混合气体通过盛有足量溴水的洗气瓶 | |
| C. | 混合气体通过盛水的洗气瓶 | |
| D. | 混合气体与氢气混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 气体的总体积 | ||
| C. | 混合气体的相对分子质量 | D. | 气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验及现象 | 结论 |
| A | 将湿润红色石蕊试纸靠近试管口 | 反应中有NH3产生 |
| B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产生 |
| C | 收集气体的同时测得溶液的pH为8.0 | 生成Mg(OH)2使溶液呈弱碱性 |
| D | 向NH4Cl溶液中加锌,也有大量气泡产生 | 活泼金属可促进NH4+水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛放碱液的试剂瓶不用玻璃塞;SiO2+2OH-═SiO32-+H2O | |
| B. | 配制FeCl3溶液时要加盐酸:Fe3++3H2O?Fe(OH)3+3H+ | |
| C. | 制Cl2时用排饱和氯化钠溶液收集气体:H2O+Cl2?Cl-+H++HClO | |
| D. | 金属钠燃烧时,火焰呈黄色:2Na+O2 $\frac{\underline{\;点燃\;}}{\;}$Na2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com