考点:位置结构性质的相互关系应用,原子核外电子排布,判断简单分子或离子的构型,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:四种短周期元素A、B、C、D的原子序数依次递增.其中A、B、C二种元素基态原子的2p能级上都有未成对电子,核外电子排布式分别为1s
22s
22p
2、1s
22s
22p
3、1s
22s
22p
4,则A为碳、B为N、C为O;D与C可以形成D
2C和D
2C
2两种化合物,则D为Na,
(1)碳元素与氢元素形成的某种气态化合物在标准状况下的密度为1.161g?L
-1,则该化合物的相对分子质量=1.161×22.4=26,应是C
2H
2,根据C原子形成的σ键及孤对电子判断杂化方式;
(2)同周期随原子序数增大第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,处于半满稳定状态,能量较低;
(3)不同能层能量形成较大,故失去不同能层的电子时,电离能发生突增;
(4)由晶胞图可知晶胞中每个C形成4个C-O键,每个O形成2个O-C键,形成空间的立体网状结构,该晶体的类型属于原子晶体,根据C原子形成的σ键及孤对电子判断杂化方式;
(5)C和C形成原子个数比为1:3的常见离子为CO
32-,计算C原子价层电子对数与孤电子对,确定其空间构型;
(6)由Na
2O晶胞结构结构可知,晶胞中黑色球数目=8×
+6×
=4,白色球数目=8,故白色球为Na
+离子、黑色球为O
2-,根据白色球周围的黑色球数目判断Na
+离子的配位数;
以晶胞中上面心O
2-离子为研究对象,距一个O
2-周围最近的Na
+离子有8个,位于晶胞中上层4个Na
+及上面晶胞中的下层4个Na
+,8个Na
+离子构成的几何体中每个都是正方形,形成立方体结构;
计算晶胞的质量,棱长=
.
解答:
解:(1)碳元素与氢元素形成的某种气态化合物在标准状况下的密度为1.161g?L
-1,则该化合物的相对分子质量=1.161×22.4=26,应是C
2H
2,分子中C原子没有孤对电子、形成2个σ键,采取sp杂化,
故答案为:sp;
(2)同周期随原子序数增大第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能C<O<N,
故答案为:C<O<N;
(3)D为Na元素,第三能层只有3s
1,第3能层与第2能层能量相差较大,故失去第2能层时电子需要能量突增,即电离能第一次突增应出现在第二电离能,
故答案为:二;
(4)由CO
2在高温高压下所形成的晶体晶胞图,可知晶胞中每个C形成4个C-O键,每个O形成2个O-C键,形成空间的立体网状结构,该晶体的类型属于原子晶体,该晶体中C原子形成4个σ键,没有孤对电子,C原子采取sp
3杂化,
故答案为:原子;sp
3;
(5)C和C形成原子个数比为1:3的常见离子为CO
32-,离子中C原子孤电子对数=
=0、价层电子对数=3+0=3,故这种微粒的空间构型为平面三角形,
故答案为:平面三角形;
(6)由Na
2O晶胞结构结构可知,晶胞中黑色球数目=8×
+6×
=4,白色球数目=8,故白色球为Na
+离子、黑色球为O
2-,该晶体中Na
+离子周围有4个O
2-,故Na
+离子的配位数为4;
以晶胞中上面心O
2-离子为研究对象,距一个O
2-周围最近的Na
+离子有8个,位于晶胞中上层4个Na
+及上面晶胞中的下层4个Na
+,8个Na
+离子构成的几何体中每个都是正方形,形成立方体结构;该晶胞质量=4×
g,该晶胞的密度为ρ g?cm
-3,
则晶胞边长a=
=
cm,
故答案为:4;立方体;
.
点评:本题考查物质结构与性质,涉及核外电子排布、电离能、分子结构与杂化轨道、晶胞结构与计算,晶胞结构对学生的空间想象有一定的要求,注意利用均摊法进行计算,难度中等.

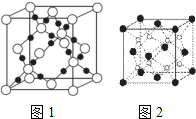 四种短周期元素A、B、C、D的原子序数依次递增.其中A、B、C三种种元素基态原子的2p能级上都有未成对电子.且未成对电子个数分别是2、3、2;D与C可以形成D2C和D2C2两种化合物.回答下列问题:
四种短周期元素A、B、C、D的原子序数依次递增.其中A、B、C三种种元素基态原子的2p能级上都有未成对电子.且未成对电子个数分别是2、3、2;D与C可以形成D2C和D2C2两种化合物.回答下列问题:

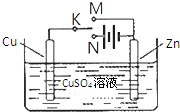 某学习小组为研究电化学原理,设计如图装置.下列叙述正确的是( )
某学习小组为研究电化学原理,设计如图装置.下列叙述正确的是( )
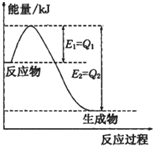 反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如右图所示,则该反应是
反应A(g)+B(g)═C(g)+D(g)过程中的能量变化如右图所示,则该反应是