
已知亚硫酸钠在空气中能被氧气氧化生成硫酸盐。
Ⅰ.甲同学设计两种方案来检验Na2SO3溶液是否发生变质。
方案一:取样,加入稀盐酸有气泡生成,认为亚硫酸钠溶液没有变质。
方案二:取样,加入氯化钡溶液有白色沉淀生成,认为亚硫酸钠溶液完全变质。
请你对两方案作出评价:
方案一:________(填“合理”或“不合理”),理由是_______________________
________________________________________________________________________。
方案二:________(填“合理”或“不合理”),理由是____________________________
________________________________________________________________________。
Ⅱ.乙同学探究Na2SO3溶液是否发生变质,设计如下实验测定1.0 mol·L-1 Na2SO3溶液的实际浓度。
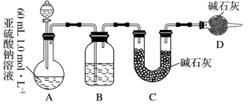
(1)分液漏斗中应加入足量的下列哪种试剂?________(填字母)
a.浓硝酸 b.65%硫酸 c.浓盐酸
(2)实验前后测得C装置增重3.2 g,则Na2SO3溶液实际的物质的量浓度为________。
(3)该实验装置还存在一个明显的缺陷是________。
答案 Ⅰ.不合理 亚硫酸钠部分变质时滴加盐酸也会产生气泡 不合理 亚硫酸钠也能与氯化钡反应生成白色沉淀,亚硫酸钠未变质或部分变质时也会产生白色沉淀
Ⅱ.(1)b (2)0.83 mol·L-1
(3)缺少一个驱赶残留二氧化硫气体的装置(或其他合理答案)
科目:高中化学 来源: 题型:
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛。
(1)C60分子能与F2发生加成反应,其加成产物为______,C60分子的晶体中,在晶胞的顶点和面心均含有一个C60分子,则一个C60晶胞的质量为________。
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是________(填字母)。
a.晶体的密度:干冰>冰
b.晶体的熔点:干冰>冰
c.晶体中的空间利用率:干冰>冰
d.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的是________(填字母)。
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C
c.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
(4)金刚石晶胞结构如下图,立方BN结构与金刚石相似,在BN晶体中,B原子周围最近的N原子所构成的立体图形为________,B原子与N原子之间共价键与配位键的数目比为________,一个晶胞中N原子数目为________。
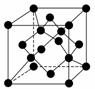
(5)C与孔雀石共热可以得到金属铜,铜原子的原子结构示意图为________,金属铜采用面心立方最密堆积(在晶胞的顶点和面心均含有一个Cu原子),则Cu的晶体中Cu原子的配位数为________。
已知Cu单质的晶体密度为ρ g·cm-3,Cu的相对原子质量为M,阿伏加德罗常数为NA,则Cu的原子半径为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关常见有机物说法正确的是( )
A.乙烯、苯、纤维素均属于烃类化合物
B.天然氨基酸能与强酸或强碱溶液反应
C.石油的蒸馏、裂化属于化学变化
D.地沟油、聚氯乙烯均属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
将含有杂质的4.0 g的NaOH固体配成1000 mL溶液,取20 mL溶液置于锥形瓶中,用0.1 mol·L-1盐酸滴定(甲基橙作指示剂),消耗盐酸20.4 mL,则该NaOH固体中含有的杂质可能是( )
A.Na2O B.Na2CO3
C.NaHCO3 D.KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生对SO2与漂粉精的反应进行实验探究:
| 操 作 | 现 象 |
| 取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
|
| ⅰ.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是____________________________________
________________________________________________________________________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是________。
(3)向水中持续通入SO2,未观察到白雾。推测现象ⅰ的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a的目的是________。
②由实验a、b不能判断白雾中含有HCl,理由是________________________________
________________________________________________________________________。
(4)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是________。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X。
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是________。
②用离子方程式解释现象ⅲ中黄绿色褪去的原因:____________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2。
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_________________。
(2)用该方法获得的Na2S2O3·H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
【提出假设】 假设1:晶体中只含Na2CO3杂质
假设2:晶体中只含Na2S杂质
假设3:________________________________________________________________________。
【查阅资料】 Na2S2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O。
【判断与思考】 某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?________(填“合理”或“不合理”)并说明理由:_________________________________________。
【设计方案进行实验】 基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂:3 mol·L-1H2SO4、1 mol·L-1NaOH、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
| 实验方案 | 现象及结论 |
(3)已知:2Na2S2O3+I2===2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010 mol·L-1的碘水进行多次取样滴定,测得Na2S2O3·5H2O的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
①难溶电解质达到沉淀溶解平衡时,溶液中各种离子的溶解(或沉淀)速率都相等
②难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,平衡向溶解方向移动
③向Na2SO4溶液中加入过量的BaCl2溶液,则SO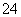 沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含SO
沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含SO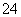
④Ksp小的物质其溶解能力一定比Ksp大的物质的溶解能力小
⑤为减少洗涤过程中固体的损耗,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀
⑥洗涤沉淀时,洗涤次数越多越好
A.①②③ B.①②③④⑤⑥
C.⑤ D.①⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com