
| Y | U | |||
| X | V | W |


分析 U的最简单气态氢化物能使湿润的红色石蕊试纸变蓝,该气体为氨气,则U为N元素;结合X、Y、U、V、W五种短周期元素在周期表中的位置可知,Y为C、X为Al、V为S、W为Cl元素;Z是人体血红蛋白中存在的金属元素,则Z为Fe元素,据此进行解答.
解答 解:U的最简单气态氢化物能使湿润的红色石蕊试纸变蓝,该气体为氨气,则U为N元素;结合X、Y、U、V、W五种短周期元素在周期表中的位置可知,Y为C、X为Al、V为S、W为Cl元素;Z是人体血红蛋白中存在的金属元素,则Z为Fe元素,
(1)Z为Fe元素,其原子序数为26,位于周期表中第四周期 第Ⅷ族;W为Cl元素,其原子序数为17,则氯原子结构示意图为: ,
,
故答案为:第四周期 第Ⅷ族; ;
;
(2)电子层越多,离子半径越大,电子层相同时核电荷数越大,离子半径越小,则X、U、V、W形成的简单离子半径由大到小的顺序为:S2->Cl->N3->Al3+,
故答案为:S2->Cl->N3->Al3+;
(3)Y为C元素,用电子式表示Y的最高价氧化物二氧化碳的形成过程为: ,
,
故答案为: ;
;
(4)X、W两元素的最高价氧化物对应水化物分别为氢氧化铝和高氯酸,二者反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(5)Na2V为Na2S,硫离子在溶液中发生水解:S2-+H2O?HS-+OH-,导致溶液呈碱性,则c(OH-)>c(H+),氢氧根离子还来自水的电离,则c(OH-)>c(HS-)>c(H+),溶液中离子浓度大小为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),
故答案为:碱性;S2-+H2O?HS-+OH-;c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+).
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期表、元素周期表的关系,试题培养了学生的逻辑推理能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
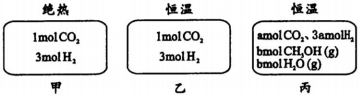
| A. | 刚开始反应时速率:甲>乙 | B. | 平衡后反应放热:甲>乙 | ||
| C. | 500℃下该反应平衡常数:K=3×102 | D. | 若a≠0,则0.9<b<l |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用水吸收NO2生产硝酸:3NO2+H2O=2HNO3+NO | |
| B. | 用熟石灰处理泄漏的液氯:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O | |
| C. | Cu与稀硝酸反应制取硝酸铜:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| D. | 用明矾除去水中的悬浮颗粒物:Al3++3H2O?Al(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O→18O的转化属于化学变化 | |
| B. | 冰醋酸、消石灰、明矾、生石灰分别属于酸、碱、盐、氧化物 | |
| C. | SiO2既能与氢氟酸反应,也能与氢氧化钠溶液反应,属于两性氧化物 | |
| D. | 少量Cu将足量浓、稀硝酸分别还原为NO2和NO,其转移电子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国科学家屠呦呦因发现治疗疟疾的特效药青蒿素而获诺贝尔生理医学奖.青蒿素的结构如图所示,有关青蒿素的说法不正确的是( )
我国科学家屠呦呦因发现治疗疟疾的特效药青蒿素而获诺贝尔生理医学奖.青蒿素的结构如图所示,有关青蒿素的说法不正确的是( )| A. | 青蒿素分子式为C15H22O5 | |
| B. | 青蒿素分子内的过氧基团是对付疟原虫的核心基团 | |
| C. | 青蒿素能够发生水解反应 | |
| D. | 青蒿素分子中有6个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
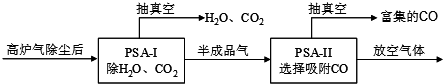
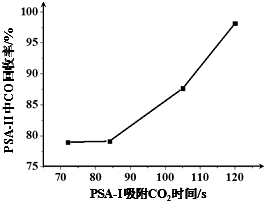
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Fe2+、SO32-、MnO4- | B. | Na+、Cl-、NO3-、SO42- | ||
| C. | Al3+、S2-、Cl-、SO42- | D. | Na+、AlO2-、Br-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com