
| A. | .常温常压下,18 g H2O中含有的电子总数为10NA | |
| B. | .1 mol•L-1 NaCl溶液含有NA个Na+ | |
| C. | 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为3 NA | |
| D. | 标准状况下,2.24LCH4所含中子数为NA |
分析 A.依据n=$\frac{m}{M}$计算水的物质的量,结合1mol水含有10个电子;
B.溶液体积未知;
C.NO2和N2O4最简式相同为NO2,计算92gNO2中所含原子数;
D.1个甲烷分子含有6个中子.
解答 解:A.常温常压下,18 g H2O中含有的电子总数为$\frac{18g}{18g/mol}$×10×NA=10NA,故A正确;
B.溶液体积未知,无法计算溶液中钠离子个数,故B错误;
C.NO2和N2O4最简式相同为NO2,计算92gNO2中所含原子数=$\frac{92g}{46g/mol}$×3×NA=6NA,故C错误;
D.标准状况下,2.24LCH4物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,含中子数为0.6NA,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意物质的结构组成,题目难度不大.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 3Cl2+6KOH═5KCl+KClO3+3H2O | B. | 2NO2+2NaOH═NaNO3+NaNO2+H2O | ||
| C. | Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | D. | SnCl4+2H2O═SnO2+4HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
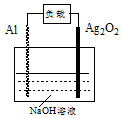 铝-氧化银电池是一种可供重型鱼雷使用的军用电池,4Al+3Ag2O2=2Al2O3+6Ag. 下列说法正确的是( )
铝-氧化银电池是一种可供重型鱼雷使用的军用电池,4Al+3Ag2O2=2Al2O3+6Ag. 下列说法正确的是( )| A. | Ag2O2 为电池的正极 | B. | NaOH溶液为电解质溶液 | ||
| C. | 电池工作时,OH-向正极移动 | D. | 电池工作时,电能转变为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量是国际单位制中的七个基本物理量之一 | |
| B. | 物质的量实质上就是物质的数量 | |
| C. | 常用6.02×1023表示阿伏伽德罗常数 | |
| D. | 阿伏伽德罗常数是12g碳中所含的碳原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O>NH3>H2 | B. | CsCl>KCl>NaCl | ||
| C. | SiO2>CO2>Hg | D. | 硅>金刚石>石英砂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 向NaAlO2溶液中通入少量的CO2的反应为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| C. | FeBr2与足量的Cl2反应为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢能是一种极具发展潜力的清洁能源.
氢能是一种极具发展潜力的清洁能源.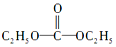 ,则碳酰肼的结构简式为
,则碳酰肼的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上第一次月考化学试卷(解析版) 题型:选择题
向0.1mol/L CH3COOH溶液中加入CH3COONa晶体或加等体积水稀释时,都会引起( )
A.溶液的pH增大 B.CH3COOH的电离程度增大
C.溶液的导电能力减小 D.溶液的c (OH–)减小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省唐山市高二上10月月考化学试卷 (解析版) 题型:填空题
2007年10月24日我国在西昌卫星发射中心用长征三号甲运载火箭将“嫦娥一号”卫星成功送入太空。“嫦娥一号”是我国自主研制的第一颗月球探测卫星,它的发射成功,标志着我国实施绕月探测工程迈出重要一步。
(1)火箭升空时,由于大气层的剧烈摩擦,产生高温,为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是( )
A.在高温下不熔化 B.在高温下可分解气化
C.在常温下就分解为气体 D.该涂料不可能发生分解
(2)肼(N2H4)是火箭发动机的燃料,它与N2O4反应时N2O4为氧化剂,生成氮气和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ·mol-1,
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0 kJ·mol-1,
则肼跟N2O4反应的热化学方程式为_______________。
(3)已知H2O(l)=H2O(g),△H=+44kJ/mol-1。则16g液态肼与足量的N2O4反应生成氮气和液态水时放出的热量是_______________kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com