
【题目】某小组设计如下图装置研究电化学原理,下列说法中错误的是( )

A. 若开始时开关K与a连接,其反应与钢铁的吸氧腐蚀类似
B. 若开始时开关K与b连接,则该装置是化学能转变为电能
C. 若开始时开关K与b连接,则标准状况下B极产生2.24 L气体,转移电子0.2 mol
D. 若开始时开关K与b连接,其原理类似于钢铁防护中外加电流的阴极保护法
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将11.2g铁投入200mL某浓度的盐酸中,铁和盐酸恰好完全反应。求:
(1)11.2g铁的物质的量
(2)所用盐酸中HCl的物质的量浓度
(3)反应中生成的H2在标准状况下的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾是对大气中各种悬浮颗粒物含量超标的笼统表述,但雾和霾的区别很大。雾是由大量悬浮在近地面空气中的微小水滴或冰晶组成的气溶胶系统,属于自然现象。霾是空气中的灰尘、硫酸、硝酸等颗粒物组成的气溶胶系统造成视觉障碍,属于大气污染。如图为霾的主要成分示意图。下列说法不正确的是
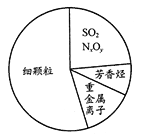
A. 汽车尾气的大量排放是造成雾霾天气的人为因素之一
B. 雾天开车时,汽车车灯的光束在雾中能产生丁达尔效应
C. 苯、甲苯、二甲苯都属于芳香烃
D. SO2和NxOy都属于酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种安全无毒的物质,带有结晶水,通常还含有CaO。经审查,面粉中添加过氧化钙已无技术上的必要性,因此,卫生部严令禁止在面粉生产中添加等添加剂。但过氧化钙在工农业生产中广泛用作杀菌剂、防腐剂、解酸剂、油类漂白剂等。
(1)称取5.42 g过氧化钙样品,灼热时发生如下反应:
2[CaO2·xH2O] → 2CaO + O2↑+ 2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为________。
(2)另取同一样品5.42 g,溶于适量稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 7.0 g。
①样品中CaO的质量为________。
②样品中CaO2·xH2O中的x值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钙常用于道路融冰剂和干燥剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al2O3、Fe2O3等杂质)制备氯化钙的主要流程如下:
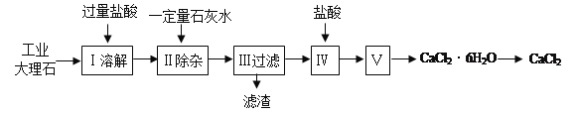 完成下列填空:
完成下列填空:
(1)上述使用的盐酸的物质的量浓度约为6.0mol/L,若用36.5%的盐酸(密度为1.2g/mL)配置6.0mol/L的盐酸100mL,所需的玻璃仪器有玻璃棒、量筒、胶头滴管、 ;需要量取36.5%的盐酸 mL;配制过程中,若其他操作都正确,下列操作会引起浓度偏小的是 。
A.定容摇匀后发现液面低于刻度线 |
B.定容时俯视容量瓶的刻度线 |
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作 |
D.如果加水超过了刻度线,取出少量水使液面恰好到刻度线 |
(2)步骤Ⅰ中有关反应的离子方程式有: 、 、 。
(3)步骤Ⅱ控制石灰水用量的目的是防止(用离子方程式表示): 。
(4)滤渣的主要成分有(写化学式) 。
(5)步骤Ⅴ所含的操作依次是 、 。
(6)制得的氯化钙可以通过如下步骤测定其纯度:
①称取5.5g无水氯化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④ 、 ;⑤称量。若得到4.3g碳酸钙,则氯化钙的质量分数为 ;若实验操作规范而测定结果偏低,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组需要480 mL 0.1000 mol/L的NaOH溶液。欲在实验室用固体烧碱配制。请回答下列问题:

(1)本实验需用托盘天平称量烧碱的质量为_____g。
(2)配制过程中,不需要的仪器(填写代号)________________。
a.烧杯 b.冷凝管 c.玻璃棒 d.1000mL容量瓶 e.漏斗 f.胶头滴管
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的仪器有药匙、___、___。
(4)请说出本实验中玻璃棒的作用____________。
(5)将上图中的实验步骤A~F按实验过程先后次序排列______________。
(6)请用恰当的文字描述上图A操作的过程____________________________。
(7)若配制过程中,其他操作都准确,下列操作能引起浓度偏高的有______(填代号)。
①用来溶解NaOH的烧杯里面有少许水
②未等稀释后的NaOH溶液冷却至室温就转移到容量瓶中
③将NaOH溶液转移到容量瓶时,不小心撒到了外面少许
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应知识贯穿于中学化学教材,从初中阶段的简单了解,到高中基本理论知识,再到元素化合物部分的实际应用,再到化学电源本质的理解,再到有机化学中物质类型的变化关系,层层推进,高潮迭起。分析氧化还原反应常用双线桥法和单线桥法来表示电子转移的方向和数目。
I.在KClO3+6HCl=KCl+3Cl2↑+3H2O的反应中:
(1)请用单线桥法标出电子转移的方向和数目________;
(2)该反应中,氧化产物与还原产物的物质的量之比为_____________;
(3)若生成 0.3 mol Cl2,则转移的电子的数目为________________;
II.已知硫化亚铁是一种黑色块状固体,在空气中煅烧时生成二氧化硫气体和烧渣;硫化亚铁常温下难溶于水,易溶于稀盐酸、稀硫酸而生成能溶于水的硫化氢气体。硫化亚铁与浓硫酸加热条件下,可发生反应:2FeS+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑ +2S+6H2O:
Fe2(SO4)3+3SO2↑ +2S+6H2O:
(4)请用双线桥法标出电子转移的方向和数目_______。
(5)H2SO4在该反应中显示出来的性质是___________;(填序号)
A.氧化性 B.还原性 C.酸性 D.碱性
(6)该反应中,氧化产物是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)。

(1)写出MgCO3分解的化学方程式__________________________。
(2)装置C的作用是__________________________,处理尾气的方法为__________。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末是_________。
②甲组步骤1中反应的离子方程式为_______________________________________________。
③乙组步骤4中,溶液变红的原因为_______________________________________________。
④从实验安全考虑,题图装置还可采取的改进措施是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )

A. 水合铜离子的模型如图甲所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图乙所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图丙所示,H原子核外大多数电子在原子核附近运动
D. 金属Cu中Cu原子堆积模型如图丁所示,为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com