
| A、2NH4Cl+Ca(0H)2═2NH3+2H20+CuCl2 |
| B、2Na202+2H20═4Na0H+02 |
| C、2S02+02═2S03 |
| D、Cu+2H2S04(浓)═CuS04+S02+2H20 |


科目:高中化学 来源: 题型:
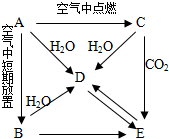 A、B、C、D、都含同一种元素,C为一种淡黄色的固体.它们按下图所示的关系相互转化,已知A为单质.分别写出有关反应的化学方程式.
A、B、C、D、都含同一种元素,C为一种淡黄色的固体.它们按下图所示的关系相互转化,已知A为单质.分别写出有关反应的化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.3克金属钠变为钠离子失去的电子数目为0.1NA |
| B、18克水所含有的电子数目为NA |
| C、常温常压下,11.2L氯气所含的原子数目为NA |
| D、2.8克N2和CO混合气体的原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1215.9MPa,473K |
| A、等质量白磷的总能量低于黑磷的总能量 |
| B、黑磷与白磷完全燃烧的产物不同 |
| C、白磷转化为黑磷是氧化还原反应 |
| D、白磷转化为黑磷是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、LiH与D2O反应,所得氢气的摩尔质量为4g/mol |
| B、1 mol LiAlH4在125℃完全分解,转移3 mol电子 |
| C、LiAlH4溶于适量水得无色溶液,则化学方程式可表示为:LiAlH4+2H2O=LiAlO2+4H2↑ |
| D、LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量的SO2通入到漂白粉溶液中:ClO-+SO2+H2O=HClO+HSO3- |
| B、Fe(OH)2与稀硝酸反应:2H++Fe(OH)2=Fe2++2H2O |
| C、向NH4HCO3溶液中加入足量NaOH溶液并加热:HCO3-+NH4++2OH-=NH3↑+2H2O+CO32- |
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
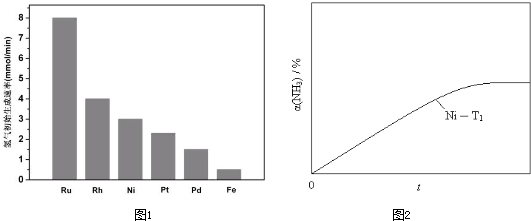
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com