
| 32.64g |
| 64g/mol |
| 11.2L |
| 22.4L/mol |
| 32.64g |
| 64g/mol |
| 11.2L |
| 22.4L/mol |
|
|


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
| A、Al3+ Na+ NO3- Cl- |
| B、K+ Na+ Cl-NO3- |
| C、K+ Na+ Cl-HCO3- |
| D、K+S042- Fe2+ NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | |||||||||||||||||
| ④ | ⑤ | ⑥ | |||||||||||||||
| ② | ③ | ⑦ | |||||||||||||||
| Fe | |||||||||||||||||
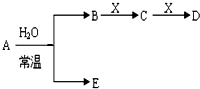

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
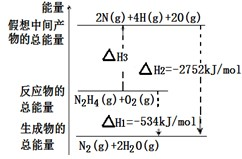
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com