
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3?Cu(OH)2 |
| ||
| 铜的原子量×原子个数 |
| 分子量 |
| ||
| 铜的原子量×原子个数 |
| 分子量 |
| 64 |
| 64+56+32×2 |
| 64×5 |
| 64×5+56+32×4 |
| 64×2 |
| 64×2+32 |
| 64×2 |
| 64×2+12+16×5+1×2 |
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
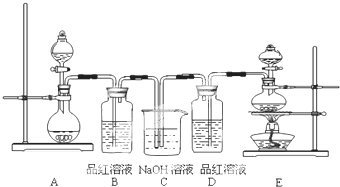
查看答案和解析>>
科目:高中化学 来源: 题型:
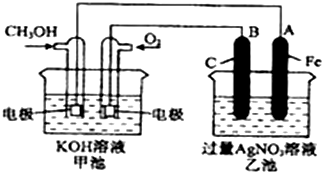
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯水加入有色布条,有色布条褪色,说明溶液中有Cl2存在 |
| B、氯水溶液呈黄绿色,有刺激性气味,说明有Cl2存在 |
| C、氯水加入盐酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在 |
| D、氯水加入NaOH溶液,氯水黄绿色消失,说明有HClO存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
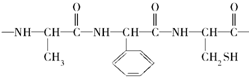 糖类、油脂和蛋白质在人类的生命活动过程中起重要作用,请根据糖类、油脂、蛋白质的有关性质回答下列问题:
糖类、油脂和蛋白质在人类的生命活动过程中起重要作用,请根据糖类、油脂、蛋白质的有关性质回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
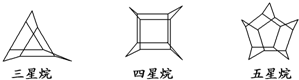
| A、它们之间互为同系物 |
| B、三星烷的化学式为C9H12 |
| C、三星烷与丙苯互为同分异构体 |
| D、它们的一氯代物均只有两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 客观事实 | 理论解释 |
| A | Na+比Na原子稳定 | Na+最外电子层电子数有8个而Na只有1个 |
| B | 熔化状态下NaCl能导电而NaCl晶体不能导电 | 熔化状态下的NaCl中存在离子而NaCl晶体中没有离子 |
| C | 同温同压同物质的量的气体体积相等 | 相同条件下气体的分子间平均距离相等 |
| D | 钠投入水中熔成小球 | 该反应为放热反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若5.6 LN2中含有N个氮分子,则阿伏加德罗常数为4N |
| B、1mol?L-1NaCl溶液含有NA个Na+离子 |
| C、14 g CO气体中所含的分子数为0.5NA |
| D、标准状况下,22.4 L CCl4含有的分子总数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com