
分析 有A、B、C、D四种元素,其价电子数依次为1、2、6、7,分别处于ⅠA族、ⅡA族、ⅥA族、ⅦA族,D-的电子层结构与Ar原子相同,则D为Cl元素,其电子层数依次减少一层,则A比D多3个电子层,应为Cs,B比D多2个电子层,应为Sr,C为Se元素,结合元素周期率解答该题.
解答 解:有A、B、C、D四种元素,其价电子数依次为1、2、6、7,分别处于ⅠA族、ⅡA族、ⅥA族、ⅦA族,D-的电子层结构与Ar原子相同,则D为Cl元素,其电子层数依次减少一层,则A比D多3个电子层,应为Cs,B比D多2个电子层,应为Sr,C为Se元素,同周期元素从左到右金属性逐渐减小,非金属性逐渐增强,同主族元素从上到下金属性逐渐增强,非金属性逐渐减弱,则金属性Cs>Sr>Se>Cl,电负性Cl>Se>Sr>Cs,
答:①这四种元素分别为Cs、Sr、Se、Cl;②电负性由小到大的顺序为Cs<Sr<Se<Cl,③金属性由弱到强的顺序为Cl<Se<Sr<Cs.
点评 本题考查结构性质位置关系应用,为高频考点,侧重于学生的分析能力的空啊差,推断元素是解题关键,侧重对元素周期律的考查,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
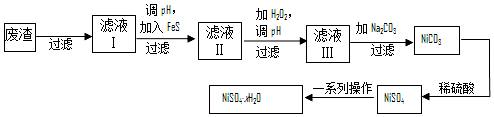
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
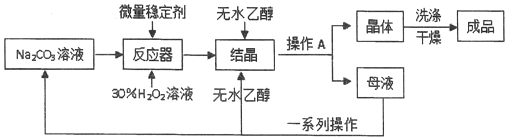

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 CH3COOH溶液与0.1 mol•L-1NaOH溶液等体积混合 | |
| B. | 向40mL0.2 mol•L-1的NaOH溶液中通入67.2mLCO2(标况) | |
| C. | 在100mL1 mol•L-1NH4Cl溶液中,投入3.9gNa2O2 | |
| D. | 在20mL0.01 mol•L-1Ma(HCO3)2溶液中,投入0.2g Ma(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层的电子数随核电荷数的增加而增多 | |
| B. | 单质颜色随核电荷数的增加而加深 | |
| C. | 氢化物的稳定性随核电荷数的增加而减弱 | |
| D. | 非金属性随核电荷数的增加而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
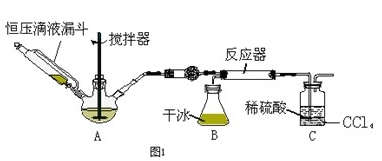
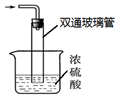
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COOH):①>② | B. | c(CH3COO-):①>② | ||
| C. | c(CH3COOH)+c(CH3COO-):①=② | D. | c(CH3COO-)+c(OH-):①<② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com