
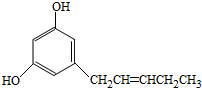
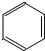
 都是平面型分子
都是平面型分子分析 (1)Cu元素原子核外电子数为29,其基态原子的电子排布式为1s22s22p63s23p43d104s1,Cu原子失去4s、3d能级的1个电子形成Cu2+;
(2)活泼金属和活泼非金属元素之间易形成离子键、非金属元素之间易形成共价键,铵盐中都含有离子键;
(3)A.共价单键为σ键,共价双键中含有一个σ键一个π键;
B.两种元素非金属性差距越大极性越大;
C.结构对称,正负电荷重心重合的分子为非极性分子;
D.该物质中含有酚羟基,所以该分子的分子之间能形成氢键;
(4)A.连接四个不同的原子或原子团的碳原子为手性碳原子,含有手性碳原子的分子为手性分子;
B.NH4+和CH4的空间构型都是正四面体结构;
C. 是平面型分子,根据价层电子对互斥理论判断BF3空间构型;
是平面型分子,根据价层电子对互斥理论判断BF3空间构型;
D.CO2是直线形分子、H2O是V形分子;
(5)A.同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
B.能和水形成氢键的物质溶解性大;
C.氢化物的熔沸点随着相对分子质量的增大而增大,但含有氢键的氢化物熔沸点较高;
D.晶格能与离子半径成反比、与离子电荷成正比.
解答 解:(1)Cu元素原子核外电子数为29,其基态原子的电子排布式为1s22s22p63s23p63d104s1,Cu原子失去4s、3d能级的1个电子形成Cu2+,Cu2+的核外电子排布式为:1s22s22p63s23p63d9,
故答案为:1s22s22p63s23p63d9;
(2)A.MgO中只含离子键,故错误;
B.NaOH中含有离子键和共价键,故正确;
C.CaCl2中只含离子键,故错误;
D.(NH4)2SO4中含有离子键和共价键,故正确;
故选BD;
(3)A.共价单键为σ键,共价双键中含有一个σ键一个π键,该分子中含有碳碳双键,所以既有σ键又有π键,故正确;
B.两种元素非金属性差距越大极性越大,O-H之间的非金属性之差大于C-H之间的非金属性之差,所以O-H键的极性强于C-H键的极性,故正确;
C.结构对称,正负电荷重心重合的分子为非极性分子,该分子结构不对称,正负电荷重心不重合,所以为极性分子,故错误;
D.该物质中含有酚羟基,所以该分子的分子之间能形成氢键,故错误;
故选CD;
(4)A.HOCH2CH(OH)CH2OH不是手性分子,故A错误;
B.NH4+和CH4中中心原子价层电子对个数都是4且不含孤电子对,所以其空间构型都是正四面体结构,故B正确;
C.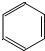 是平面型分子,BF3中B原子价层电子对个数是3且不含孤电子对,所以为平面三角形结构,故C正确;
是平面型分子,BF3中B原子价层电子对个数是3且不含孤电子对,所以为平面三角形结构,故C正确;
D.CO2是直线形分子、H2O是V形分子,故D错误;
故选AD;
(5)A.同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能N>O,故错误;
B.能和水形成氢键的物质溶解性大,乙醇和水能形成氢键、乙醚和水不能形成氢键,所以水溶性CH3CH2OH>CH3CH2OCH2CH3,故正确;
C.氢化物的熔沸点随着相对分子质量的增大而增大,但含有氢键的氢化物熔沸点较高,HF中含有氢键、HCl中不含氢键,所以沸点HCl<HF,故错误;
D.晶格能与离子半径成反比、与离子电荷成正比,氯化钠中离子半径都大于MgO中离子半径,且电荷小于MgO中电荷,所以晶格能NaCl<MgO,故错误;
故选B.
点评 本题考查物质结构、性质,涉及熔沸点、晶格能、氢键、原子杂化、微粒空间构型判断、原子核外电子排布等知识点,这些都是高频考点,难点是空间构型及原子杂化方式判断,注意氢键只影响物理性质,不影响化学性质,影响物质熔沸点、溶解度等.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题
 C、N、O、Al、Si、Cu是常见的六种元素.
C、N、O、Al、Si、Cu是常见的六种元素.| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al>Si | N<O | 金刚石>晶体硅 | CH4<SiH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
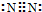 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.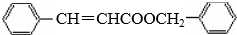 .
.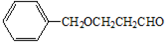 B.
B.

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及现象 | 结论 | |
| A | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 | Br-还原性强于Cl- |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
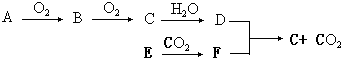
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
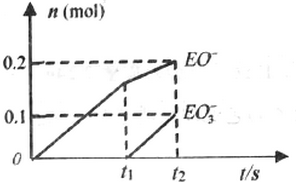
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5的NH4Cl溶液或醋酸溶液中,由水电离出的c(H+)均为10-9mol•L-1 | |
| B. | 常温下,将pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| C. | 在c(H+):c(OH-)=1:l012的溶液中,Na+、I-、NO3-、SO42-能大量共存 | |
| D. | 0.1 mol•L-1 Na2CO3溶液和0.1 mol•L-1 NaHSO4溶液等体积混合,溶液中:c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钙和铁粉常用作食品干燥剂 | |
| B. | 二氧化硫有毒所以不能用作食品防腐剂 | |
| C. | 碳酸钡不溶于水因此在医疗上用作钡餐 | |
| D. | 当光束通过稀豆浆时能产生丁达尔效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com