
【题目】我国科研人员研制出一种室温“可呼吸”Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如右图所示。吸收的全部CO2中,有![]() 转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是( )
转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是( )

A. “吸入”CO2时,钠箔为正极
B. “吸入”CO2时的正极反应:4Na++ 3CO2+ 4e-= 2Na2CO3+ C
C. “呼出”CO2时,Na+向多壁碳纳米管电极移动
D. 标准状况下,每“呼出”22.4 L CO2,转移电子数为0.75 mol
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列混合物可用溶解、过滤、蒸发的操作达到分离目的的是( )
A.面粉与食盐的混合物B.石灰石与泥沙的混合物
C.碘与酒精的混合物D.泥沙与氯化钠的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冰晶石(Na3A1F6)微溶于水,工业上用萤石(CaF2含量为96%)、二氧化硅为原料,采用氟硅酸钠法制备冰晶石,其工艺流程如下:

(1)Na3AlF6中氟、铝以共价键结合,写出Na3A1F6中所含阳离子的电子式____________,滤渣A的主要成分是___________(填名称)。
(2)为探究适合“酸浸”的条件,取4份相同样品进行实验,所得结果如下表所示:

①实验3比实验2获得。Na2SiF6的质量低的原因可能是_________________________。
②选择“酸浸”时所采用的最适合条件为_____________________。
(3)写出反应③的离子方程式:______________________________。
(4)“操作i”不能用硅酸盐质设备进行分离的原因_____________________________。
(5)经测定,操作i所得滤液中所含杂质中K+浓度为0.05mol·L-1,当Na+浓度降为0.01mol·L-1时,若不考虑其它离子影响和溶液体积变化,K+_____(填“是”或“否”)开始沉淀。(已知25℃时,Ksp(Na3AlF6)=4.0×10-10,Ksp(K3A1F6)=6.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1) ①由上表数据可知该反应的△H_____0(填填“>”、“”或“<”)。
②下列措施能用勒夏特列原理解释是______(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500℃左右 d.需要使用过量的N2,提高H2转化率
(2) 0.2mol NH3溶于水后再与含有0.2mol H2SO4的稀溶液完全反应放热Q kJ,请你用热化学方程式表示其反应式_________________。
(3)常温时,将a mol 氨气溶于水后,再通入b mol 氯化氢,溶液体积为1L,且c(NH4+)=c(Cl-),则一水合氨的电离平衡常数Kb=_______(用ab 表示)。
(4)原料气H2可通过反应CH4 (g) +H2O (g)![]() CO (g) +3H2(g) 获取,已知该反应中,当初始混合气中的
CO (g) +3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
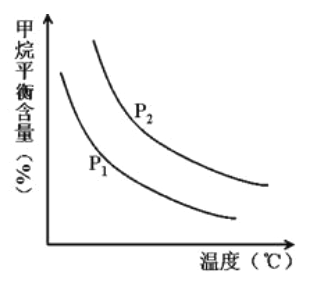
①图中,两条曲线表示压强的关系是: P1__P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会______(填“增大”,“减小”或“不变”)。
(5)原料气H2还可通过反应CO (g) +H2O (g)![]() CO2 (g) +H2(g) 获取。
CO2 (g) +H2(g) 获取。
①T℃时,向容积固定为5L的容器中充入1mol H2O (g) 和1mol CO,反应达平衡后,测得CO的浓度0.08 mol/L,该温度下反应的平衡常数K值为_________。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
C.单位时间内生成a mol CO 的同时消耗a mol H2
d.混合气中n (CO): n (H2O): D (CO2): n (H2)=1: 16: 6: 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中错误的是( )


A. 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B. 装置②中钢闸门应与外接电源的负极相连
C. 装置③的总反应式是Cu+2Fe3+=Cu2++2Fe2+
D. 装置④中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:

(1)分解池中主要物质是_______________。(填化学式)
(2)在合成塔中,若有4400g CO2与足量H2反应,生成气态的H2O和甲醇,可放出5370kJ的热量,该反应的热化学方程式为_______________________________________。
(3)该工艺体现了“绿色自由”构想的“绿色”理念的方面有_______________________(任答一条)。
(4)一定条件下,往2 L恒容密闭容器中充入1mol CO2和3mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:

(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是_________(填“反应I”、“反应II”、“反应III”)。同一种催化剂,温度越高,催化效果____(填“不变”、“增强”、“减弱”),分析其原因可能是_________(填字母)。
A.温度升高,平衡逆向移动 B.温度升高,催化剂失活
C.温度升高,催化剂脱附率增加 D.温度升高,平衡常数减小
②b点v(正)______v(逆)(填“>”、“<”或“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是__________。
④c点时该反应的平衡常数K=______。
(5)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为___________________________,若导线中通过电子为a mol,则M极电解质溶液中H+改变量为________mol。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1 mol AlN需转移3 mol电子
C. AlN中氮的化合价为+3
D. AlN的摩尔质量为41 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (甲)、
(甲)、 (乙)、
(乙)、 (丙)的分子式均为C8H8,下列说法不正确的是
(丙)的分子式均为C8H8,下列说法不正确的是
A. 甲、乙、丙在空气口燃烧时均产生明亮并带有浓烟的火焰
B. 甲、乙、丙中只有甲的所有原子可能处于同一平面
C. 等量的甲和乙分别与足量的溴水反应,消耗Br2的量:甲>乙
D. 甲、乙、丙的二氯代物数目最少的是丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com