
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
科目:高中化学 来源: 题型:解答题
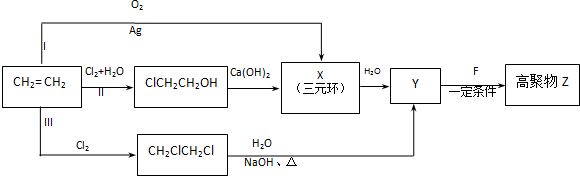
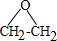 .
.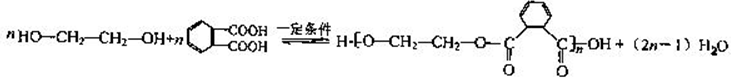 CH2ClCH2Cl→Y:CH2ClCH2Cl+2NaOH$→_{△}^{水}$CH2OHCH2OH+2NaCl.
CH2ClCH2Cl→Y:CH2ClCH2Cl+2NaOH$→_{△}^{水}$CH2OHCH2OH+2NaCl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
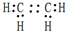 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.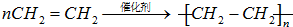 ,反应类型是加聚反应.
,反应类型是加聚反应.
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:推断题
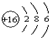 ;该元素最高正化合价与最低负化合价分别是+6和-2.
;该元素最高正化合价与最低负化合价分别是+6和-2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
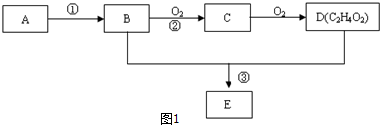
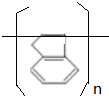
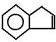 ,易发生加成、加聚等反应.茚有一种同分异构体A,A分子中的碳原子不完全在同一平面上,且A分子中含有一个苯环,A有如下转化关系:
,易发生加成、加聚等反应.茚有一种同分异构体A,A分子中的碳原子不完全在同一平面上,且A分子中含有一个苯环,A有如下转化关系: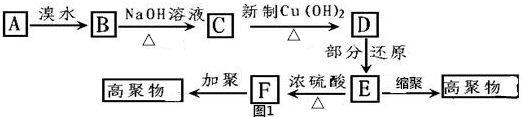
 .
.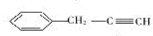 ,B是
,B是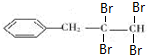 (均填结构简式).
(均填结构简式).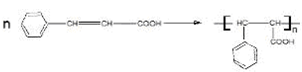 .
.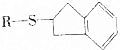 的反应类型是加成反应.
的反应类型是加成反应.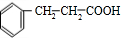 、
、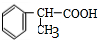 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. HCO3-+OH-. 0.2mol/L该溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
HCO3-+OH-. 0.2mol/L该溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
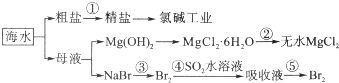
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能kJ/mol | 436 | 565 | 431 | 368 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com