
科目:高中化学 来源:不详 题型:单选题
| A. HCl和HNO3放出H2一样多 | B.醋酸中放出H2最多 |
| C.HCl中放出H2最多 | D.HNO3比醋酸放出H2多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
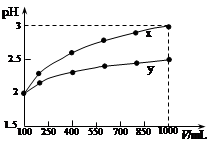
| A.稀释前x、y的物质的量浓度相等 |
| B.x为强酸,y为弱酸 |
| C.随着稀释的进行,y的电离程度减小 |
| D.等体积的x、y分别分别与足量的锌反应,x放出的氢气多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | ① | ② | ③ | ④ |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
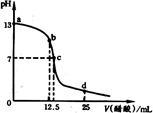
| A.若选用甲基橙指示CH3COOH滴定未知浓度的NaOH溶液的滴定终点,则测定结果偏低 |
| B.反应过程中溶液中阴、阳离子总数目:b 点大于c点 |
| C.因为CH3COONa溶液显碱性,所以当向CH3COOH溶液中加入CH3COONa时,CH3COOH电离程度将增大 |
| D.a、c区间内,c(Na+)一定大于c(CH3COO-),但c(OH-)可能大于、小于或等于c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com