
已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 + 3H2 = 2NH3
ΔH=—92.4 KJ/mol,则N≡N键的键能是( )
A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
若NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1 mol Na2CO3·10H2O晶体中,阴离子总数大于0.1NA
B.常温常压下,18 mL水中所含氢离子数约为10-7NA
C.标准状况下,22.4 L氦气中含有的原子数约为NA
D.23 g组成为C2H6O的有机物,C—H键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象不能说明相关结论的是( )
A.将铜与浓硫酸共热,产生 使石蕊溶液变红的气体,说明浓硫酸具有酸性
使石蕊溶液变红的气体,说明浓硫酸具有酸性
B.将金属钠投入冷水中,钠熔为小球,说明钠与水的反应为放热反应且钠的熔点低
C.向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl的溶解平衡正向移动
D.向Al(OH)3沉淀中滴加NaOH溶液或盐酸,沉淀均消失,说明Al(OH)3是两性氢氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
硫是一种很活泼的元素,在适宜的条件下能形成-2、+6、+4、+2、+1价的化合物。
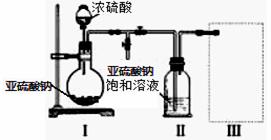 I:焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。带有强烈的SO2气味,水溶液生成NaHSO3呈酸性,久置空气中易氧化,故该产品不能久存。某研究小组采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。
I:焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。带有强烈的SO2气味,水溶液生成NaHSO3呈酸性,久置空气中易氧化,故该产品不能久存。某研究小组采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。
(1)装置I中的浓硫酸______ (能或不能)用稀硫酸代替,
原因是 。
(2)装置Ⅱ中有Na2S2O5晶体析出,要获得已析出的晶体,可采取的分离方法是_____________。
(3)装置Ⅲ用于处理尾气,请在虚线内画出尾气处理装置和药品。
(4)检验Na2S2O5晶体在空气中变质的实验方案是 。
II:而另一种硫的化合物Na2S2O3的溶液可以用于测定溶液中ClO2的含量,可进行以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
(1)准确量取10.00 mL ClO2溶液的玻璃仪器是 。
(2)确定滴定终点的现象为__________________________________。
(3)根据上述步骤计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)
(4)下列操作会导致测定结果偏高的是 。
A.未用标准浓度的Na2S2O3溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.滴定应在中性或弱酸性环境中进行,若溶液呈碱性
E.观察读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,有下列三个热化学方程式:
(1)2H2(l)+O2(g)=== 2H2O(l) △H1= -Q1 kJ• mol-1
(2)2H2(g)+O2(g)=== 2H2O(l) △H1= -Q2 kJ• mol-1
(3)2H2(l)+O2(g)=== 2H2O(g) △H1= -Q3 kJ• mol-1
则Q1、Q2、Q3的关系表示正确的是( )
A. Q1=Q2<Q3 B. Q2 > Q1 >Q3 C. Q3> Q2> Q1 D. Q1=Q2=Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
c(H+)相同的等体积的两份溶液A和B;A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出的氢气的质量相等,则下列说法正确的是( )
①反应所需要的时间B>A②开始反应时的速率A>B③参加反应的锌的物质的量A=B④反应过程的平均速率B>A⑤盐酸里有锌剩余⑥醋酸里有锌剩余
A ③④⑤ B ③④⑥ C ②③⑤ D ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行下列反应:M (g)+N (g)  R (g)+2 L
R (g)+2 L
此反应符合右边图像。下列叙述正确的是( )
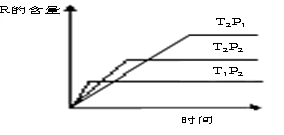
A.正反应吸热,L是气体 B.正反应吸热,L是固体
C.正反应放热,L是液体 D.正反应放热,L是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
在无色透明的酸性溶液中,能大量共存的离子组是( )
A.Al3+、Na+ 、Cl-、SO42- B.Cu2+、Ca2+ 、CO32- 、Cl-
C.NH4+、 Ba2+ 、NO3-、HCO3- D.K+ 、Fe3+、Cl- 、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
H2和I2在一定条件下能发生反应:H2(g)+I2(g)2HI(g) ΔH=-a kJ·mol-1
已知:
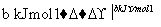

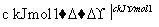
 (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A.反应物的总能量高于生成物的总能量
B.断开1 mol H—H键和1 mol I—I键所需能量大于断开2 mol H—I键所需能量
C.断开2 mol H—I键所需能量约为(c+b+a) kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com