
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式
(2)在大试管中按一定比例将乙醇、乙酸混合后充分加热,在右边小试管中未收集到有香味的液体(气密性良好),原因可能是:
。
(3)右边小试管中应先加入的试剂是:① ;②其作用是 。
(4)若乙酸中的氧元素都用18O 标识,充分反应,在反应体系中含有 18O 的物质共有 种。
(5)下列描述能说明乙醇与乙酸的酯化反应已达到该反应的限度的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时 间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
⑴ CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O
⑵ 未加 催化剂浓硫酸 ⑶ Na2CO3溶液 略 ⑷ 3 ⑸ ②④⑤
解析:考查乙酸乙酯的制备。
(1)乙醇和乙酸在浓硫酸的作用下生成乙酸乙酯和水,方程式为
CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O。
(2)酯化反应需要浓硫酸作催化剂,而实验中没有使用浓硫酸,所以不能得到乙酸乙酯。
(3)生成的乙酸乙酯中混有乙醇和乙酸,所以可通过饱和的碳酸钠溶除去。因为碳酸钠能溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度,便于乙酸乙酯分层析出。
(4)在酯化反应中酸提供羟基,醇提供氢原子,所以乙酸乙酯和水中都含有18O。又因为反应是可逆反应,所以乙酸不可能完全被消耗,因此一共有3种物质含有18O。
(5)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时,各种物质的浓度或含量均不再发生变化,这种状态是平衡状态,所以④⑤正确。①③中反应速率的方向是相同的,不正确。②中反应速率的方向相反,且满足速率速率之比是相应的化学计量数之比,正确。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
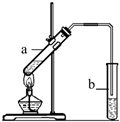 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题: CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
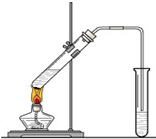 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
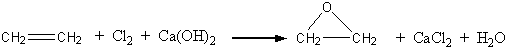
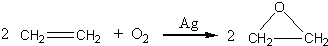
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题: CH3CO18OCH2CH3+H2O
CH3CO18OCH2CH3+H2O CH3CO18OCH2CH3+H2O
CH3CO18OCH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:
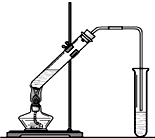 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
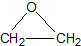
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: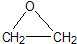 +CaCl2+H2O
+CaCl2+H2O| Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com