
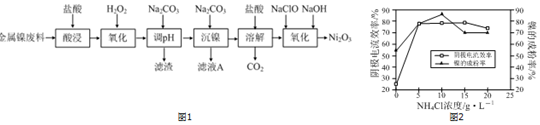
分析 酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+等,加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钠溶液调节溶液的pH,使铁离子全部沉淀,过滤后的滤液中再加入碳酸钠沉淀镍离子得NiCO3,滤液A中含有NaCl等物质,将NiCO3再溶于盐酸,得氯化镍溶液,向其中加入次氯酸钠和氢氧化钠溶液可得Ni2O3.
(1)根据化合物中化合价代数和为0计算;
(2)温度过高,HCl挥发,不利用金属离子的溶解;
(3)过氧化氢氧化亚铁离子为铁离子,加入碳酸钠溶液调节溶液的pH,使铁离子全部沉淀;
(4)工艺中分步加入Na2CO3的作用是将Fe3+和Ni2+分别沉淀出来;根据反应2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O;
(5)①选择镍的成粉率最高的浓度;
②当NH4Cl浓度大于15g•L-1时,阴极有氢气生成,导致阴极电流效率降低.
解答 解:(1)Ni2O3中氧元素-2价,化合物中化合价代数和为0,则Ni的化合价为+3;
故答案为:+3;
(2)温度过高,HCl挥发,不利用金属离子的溶解;
故答案为:温度高,HCl挥发加快;
(3)过氧化氢氧化亚铁离子为铁离子,发生的反应为:2Fe2++2H++H2O2=2Fe3++2H2O;加入碳酸钠溶液调节溶液的pH,使铁离子全部沉淀,则滤渣为Fe(OH)3;
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;Fe(OH)3;
(4)工艺中分步加入Na2CO3的作用是将Fe3+和Ni2+分别沉淀出来,为提高原料的利用率,NaClO与NaOH“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O,加入NaClO与NaOH的物质的量之比为 1:4;
故答案为:将Fe3+和Ni2+分别沉淀出来;1:4;
(5)①根据图2可知,NH4Cl的浓度为10g•L-1时,镍的成粉率最高,所以NH4Cl的浓度最好控制为10 g•L-1,浓度为$\frac{10}{53.3}$mol/L≈0.2mol/L;
故答案为:0.2;
②当NH4Cl溶液的浓度大于15g/L时,随着NH4+浓度增大,水解平衡NH4++H2?NH3•H2O+H+,向右移动,H+浓度增大,导致阴极析出H2;
故答案为:随着NH4+浓度增大,水解平衡NH4++H2?NH3•H2O+H+,向右移动,H+浓度增大,导致阴极析出H2.
点评 本题考查物质制备工艺流程,涉及反应速率影响因素、条件控制、陌生方程式书写、电解原理、信息获取能力等,是高考常考题型,是对学生综合能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 保持温度不变,减小压强 | B. | 保持恒温恒容,充入氦气 | ||
| C. | 其它条件不变时,升高温度 | D. | 其它条件不变时,加入少量A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
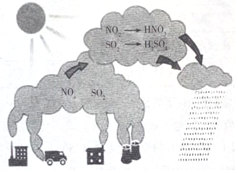
| A. | 图示过程表示了地球臭氧层的破坏过程 | |
| B. | 图中涉及的氧化物均为酸性氧化物 | |
| C. | 机动车尾气含有N的氧化产物 | |
| D. | 图示中描述的过程所涉及的反应均为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可以消毒杀菌常用于净水 | |
| B. | 氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性 | |
| C. | 氢氧化铝在医疗上是治疗胃酸过多的一种药剂 | |
| D. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | K+、Cl-、NO3-、S2- | B. | K+、Fe2+、I-、SO42- | ||
| C. | Na+、Cl-、NO3-、SO42- | D. | K+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Cl-、SO42-、K+ | B. | Mg2+、SO42-、Na+、Cl- | ||
| C. | H+、CO32-、Al3+、Cl- | D. | K+、S O32-、NO3-、H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com