
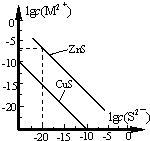
 25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )
25℃时,用Na2S 沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列说法不正确的是( )| A. | Na2S 溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) | |
| B. | 25℃时,Ksp(CuS)约为1×10-35 | |
| C. | 向100 mL Zn2+、Cu2+浓度均为10-5 mol/L 的混合溶液中逐滴加入10-4mol/L 的Na2S 溶液,Cu2+先沉淀 | |
| D. | 向Cu2+浓度为10-5 mol/L 的工业废水中加入ZnS 粉末,会有CuS 沉淀析出 |
分析 A.根据硫化钠溶液中的物料守恒判断;
B.Ksp(CuS)=c(Cu2+)×c(S2-),根据图象数据计算出25℃时K甲(CuS);
C.依据此图可知,CuS的Ksp较小,则首先出现的沉淀是CuS;
D.在25℃下,CuS溶液的是Ksp小于ZnS的溶度积,则向Cu2+浓度为10-5mol•L-1废水中加入ZnS粉末,会有CuS沉淀析出.
解答 解:A.硫化钠溶液中的物料守恒为:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+),故A错误;
B.在25℃时,CuS饱和溶液中存在沉淀溶解平衡:CuS(s)?Cu2+(aq)+S2-(aq),Ksp(CuS)=c(Cu2+)×c(S2-)=10-25×10-10=10-35,故B正确;
C.依据此图可知,CuS的Ksp较小,故CuS最难溶,那么首先出现的沉淀是CuS,即Cu2+先沉淀,故C正确;
D.由于在25℃下,CuS溶液的是Ksp是10-35,小于ZnS溶度积,故向Cu2+浓度为10-5mol•L-1废水中加入ZnS粉末,会有CuS沉淀析出,故D正确;
故选A.
点评 本题主要考查了沉淀溶解平衡曲线,侧重于学生的分析能力和计算能力的考查,注意掌握图象曲线中lgc(M2+)、lgc(S2-)数值越大,实际浓度越小是解题的关键,难度中等.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | AgNO3溶液 | B. | 盐酸酸化的BaCl2溶液 | ||
| C. | KSCN溶液 | D. | HNO3酸化的Ba(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能使溴水、酸性高锰酸钾溶液褪色,褪色的本质相同 | |
| B. | 乙烷和乙烯分别与C12反应均有1.2二氯乙烷生成,且反应类型不同 | |
| C. | 油脂、葡萄糖、蛋白质都是人体重要的营养物质,它们都能水解 | |
| D. | 制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)?2AB3(g)的化学平衡状态的影响如图所示(T表示温度,n表示物质的量).下列判断正确的是( )
在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)?2AB3(g)的化学平衡状态的影响如图所示(T表示温度,n表示物质的量).下列判断正确的是( )| A. | 反应速率:a>b>c | B. | 达到平衡时A的转化率大小:b>a>c | ||
| C. | 若T2>T1.则正反应一定是吸热反应 | D. | 达到平衡时,n( AB3)的大小:b>a>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定没有乙烯 | ||
| C. | 混合气体中一定没有乙烷 | D. | 混合气体中可能含有C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnS使用量越大,废水中的Cu2+的去除率越高 | |
| B. | 该反应可将工业废水中的Cu2+沉淀完全 | |
| C. | 往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 | |
| D. | 该反应的平衡常数K=2.0×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
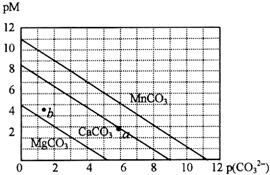 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列说法正确的是( )| A. | M离子浓度越大,pM值越大 | |
| B. | MgCO3、CaCO3、MnCO3的Ksp依次增大 | |
| C. | b点表示MgCO3为不饱和溶液,若表示CaCO3则有沉淀析出 | |
| D. | a点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com