
【题目】现有一块质量为10g的金属镁样品,经测定它的表面已有部分被氧化,将该样品投入到100mL密度1.14gmL﹣1的盐酸中,恰好完全反应并收集到0.5g氢气.求:
(1)上述反应中被还原的HCl的质量;
(2)盐酸中溶质的质量分数.(写出计算过程)
【答案】
(1)解:n(H2)= ![]() mol=0.25mol
mol=0.25mol
被还原n(HCl)=2n(H2)=2×0.25 mol=0.5mol
被还原m(HCl)=n(HCl)×M(HCl)=0.5×36.5 g=18.25g
答:上述反应中被还原的HCl的质量为:18.25g
(2)解:由方程式Mg+2HCl=MgCl2+H2↑可知,
n(Mg)=n(H2)=0.25mol
m(Mg)=0.25×24 g=6g
m(MgO)=(10﹣6)g=4g
n(MgO)= ![]() mol=0.1mol
mol=0.1mol
与氧化镁反应的HCl,由反应MgO+2HCl=MgCl2+H2O可知,n(HCl)=2n(MgO)=0.2mol
n总(HCl)=(0.5+0.2)mol=0.7mol
m总(HCl)=0.7×36.5 g=25.55g
所以w= ![]() ×100%=22.4%,
×100%=22.4%,
答:盐酸中溶质的质量分数为22.4%
【解析】反应的方程式有:MgO+2HCl=MgCl2+H2O,Mg+2HCl=MgCl2+H2↑,(1)盐酸与金属反应体现了盐酸的氧化性,被还原;(2)酸中溶质的质量分数为: ![]() .
.


科目:高中化学 来源: 题型:
【题目】亚硫酸钠溶液中加入过量的碘酸钾酸性溶液,反应的化学方程式为(未配平):
Na2SO3+KIO3+H2SO4→Na2SO4+K2SO4+I2+H2O.回答下列问题:
(1)若反应中有5mole﹣转移,则生成碘是mol.
(2)该反应过程和机理较复杂,一般认为分为以下几步:
①IO3﹣+SO32﹣→IO2﹣+SO42﹣(慢)
②IO2﹣+SO32﹣→IO﹣+SO42﹣(快)
③IO﹣+SO32﹣→I﹣+SO42﹣(快)
④5I﹣+6H++IO3﹣→3I2+3H2O(快)
⑤I2+SO32﹣+H2O→2I﹣+SO42﹣+2H2(快)
由上述条件推测,此反应的总的反应速率由第步反应决定(填序号).
(3)若预先加入淀粉溶液,由题述看,必须在离子消耗完时,蓝色现象才会产生.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图所示装置进行有关实验.请回答: 
(1)装置A中发生的化学反应方程式为 .
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是 , 其作用是 .
(3)装置B的作用是贮存多余的气体.当D处有明显的现象后,关闭旋塞K并移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是 . B中应放置的液体是(填字母) .
a.水 b.酸性KMnO4 溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18molL﹣1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①有一定量的余酸但未能使铜片完全溶解,你认为原因是 .
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是(填字母).
a.铁粉 b.BaCl2溶液 c.银粉 d.NaHCO3溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C和H2在生产、生活、科技中是重要的燃料。
①2C(s)+O2(g)= 2CO(g) △H=-220kJ/mol
②
下列推断正确的是( )
A. C(s)的燃烧热110kJ/mol
B. 2H2 (g) +O2 (g) =2H2O (g) △H=+480kJ/mol
C. C(s) +H2O(g)==CO(g) +H2 (g) △H=-220kJ/mol
D. 分解2molH2O(1),至少需要4×462kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是

A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2下,在0~t1时间内,υ(Y)=a-b/t1 mol/(L·min)
C. M点的正反应速率υ(正)大于N点的逆反应速率υ(逆)
D. M点时再加入一定量的X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《太平惠民和剂局方》中对精制蜡的过程有如下记载:“……先将蜡六两熔化作汁,以重绵滤去滓,以好酒一升,于银石器内煮蜡熔,数沸倾出,候酒冷,其蜡自浮,取蜡称用。”文中涉及的操作方法是( )
A. 萃取B. 升华C. 重结晶D. 渗析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质.
某化学小组在实验室中利用简易装置进行了铝和氧化铁的反应,发现生成的铁呈疏松多孔的褐色硬块.该小组成员认为主要原因是产生的铁中含有较多杂质,请你参与探究该褐色硬块的组成.
(1)首先将褐色硬块处理成粉末,通过实验来确定是否含有单质铝,经实验首先排除了铝的存在,则该小组成员在该实验中选用的试剂是 , 证明不含铝的实验现象为 .
(2)经初步确定后,可认为褐色硬块除Fe外,还含有Fe2O3、Al2O3 , 为验证其组成该小组设计如下流程: 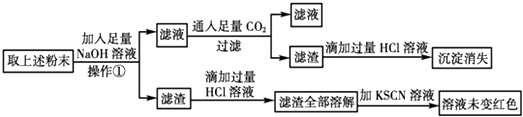
①在上述流程中,操作①所用到的玻璃仪器有 .
②通过上述实验该小组得出结论:该褐色硬块中除铁外,一定含有Al2O3 , 不含Fe2O3 , 你认为该结论是否可靠(填“是”或“否”),理由是(用离子方程式和必要的文字进行说明).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合. 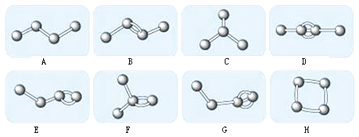
(1)图中属于烷烃的是(填编号)
(2)上图中互为同分异构体的是:A与;B与;D与 . (填编号)
(3)写出H的结构简式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com