
工业上用甲苯生产对羟基苯甲酸乙酯(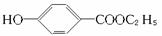 ),其过程如下:
),其过程如下:

据合成路线填写下列空白:
(1)有机物A的结构简式:____________________,B的结构简式:____________________。
(2)反应④属于____________反应,反应⑤属于______________反应。
(3)③和⑥的目的是______________________________________________。
(4)写出反应⑥的化学方程式:__________________________________________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验中,所采取的分离方法与对应原理都正确的是
| 选项 | 目的 | 分离方法 | 原理 |
| A. | 分离溶于水的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B. | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C. | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
| D. | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)是目前国际上公认的第四代高效、
无毒的消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1) ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是________。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如下:
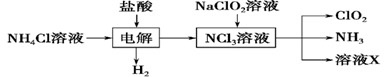
(2) 写出电解时发生反应的化学方程式:____________。
(3) 除去ClO2中的NH3可选用的试剂是________。(填序号)
A.饱和食盐水 B.碱石灰
C.浓硫酸 D.水
(4) 测定ClO2(如右图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,
再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol·L-1硫代硫酸钠标准溶液滴定(I2+2S2O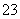 = 2I-+S4O
= 2I-+S4O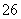 ),共用去V mL硫代硫酸钠溶液。
),共用去V mL硫代硫酸钠溶液。
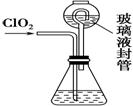
①装置中玻璃液封管的作用是_______________________________________。
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式__________________。
③滴定终点的现象是________________________________________________。
④测得通入ClO2的质量m(ClO2)=________。(用含c、V的代数式表示)
(5) 用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO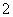
2001年我国卫生部规定,饮用水的ClO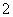 含量应不超过0.2 mg·L-1。若饮用水中ClO
含量应不超过0.2 mg·L-1。若饮用水中ClO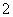 的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
的含量超标,可向其中加入适量的Fe2+,该反应的氧化产物是____________ (填化学式),其发生反应的离子方程式为_________________ __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
卤素单质及其化合物在生产和生活中有广泛应用。
Ⅰ、氟化钠主要用作农作物杀菌剂、杀虫剂、木材防腐剂。实验室以氟硅酸(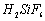 )等物质为原料、通过下图所示的流程制取较纯净的氟化钠,并得到副产品氯化铵:
)等物质为原料、通过下图所示的流程制取较纯净的氟化钠,并得到副产品氯化铵:
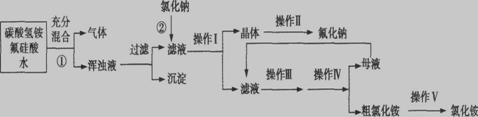
已知:20℃时氯化铵的溶解度为37.2 g,氟化钠的溶解度为4 g,Na2SiF6微溶于水。
请回答下列有关问题:
(1)完成并配平上述流程中①、②的化学反应方程式:

② 。
(2)操作Ⅲ分为两步,其顺序是 (填写所选序号)。
a、过滤 b、加热浓缩 c、冷却结晶 d、洗涤
操作Ⅱ是洗涤、干燥,其目的是 ,在操作Ⅰ~V中与之相同的操作步
骤是 。
(3)流程①中NH4HCO3必须过量,其原因是 。
Ⅱ、紫菜与海带类似,是一种富含生物碘的海洋植物,可用于食用补碘。以下为某兴趣小组模拟从紫菜中提取碘的过程:
 已知:商品紫菜轻薄松脆,比海带更易被焙烧成灰(此时碘转化为碘化物无机盐)。
已知:商品紫菜轻薄松脆,比海带更易被焙烧成灰(此时碘转化为碘化物无机盐)。
(4)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,写出反应的离子方程式:
。
(5)操作①中涉及两步操作,名称是 ,所用的主要玻璃仪器为 ,所用试剂A最好选用表格中的 (填试剂名称)。
| 乙醇 | 四氯化碳 | 裂化汽油 | 碘(晶体) | |
| 密度/g、cm-3 | 0.7893 | 1.595 | 0.71~0.76 | 4.94 |
| 沸点/℃ | 78.5 | 76.8 | 25~232 | 184.35 |
(6)将下列装置图中缺少的必要仪器补画出来,以最终将单质碘与试剂A分离:

查看答案和解析>>
科目:高中化学 来源: 题型:
A是一种有机合成中间体,其结构简式为:
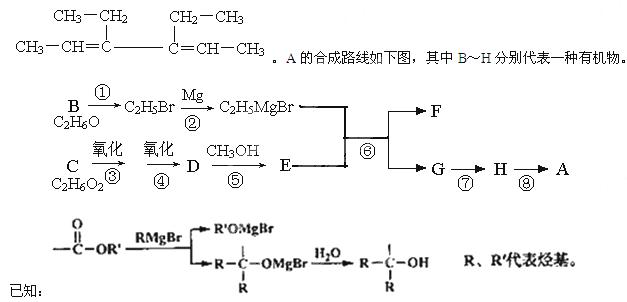
请回答下列问题:
(1)A中碳原子的杂化轨道类型有_____;A的名称(系统命名)是____;第⑧步反应类型是___。
(2)第①步反应的化学方程式是________。
(3)C物质与CH2=C(CH3)COOH按物质的量之比1:1反应,其产物经加聚得到可作隐形眼镜的镜片材料I。I的结构简式是_______________。
(4)第⑥步反应的化学方程式是________________。
(5)写出含有六元环,且一氯代物只有2种(不考虑立体异构)的A的同分异构体的结构简式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
聚酰胺66常用于生产帐蓬、渔网、降落伞及弹力丝袜等织物,可利用下列
路线合成:
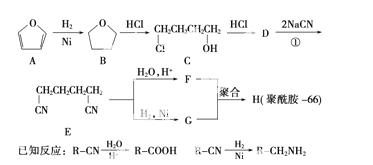
(1)能与银氨溶液反应的B的同分异构体的结构简式为__________________________。
(2)D的结构简式为________________;①的反应类型为________________。
(3)为检验D中的官能团,所用试剂包括NaOH水溶液及________________________。
(4)由F和G生成H的反应方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
普通玻璃、钢铁和玻璃钢是三种不同的材料,它们在性能方面差别很大。请根据学过的知识,回答下面问题。
(1)普通玻璃的成分是____________________________________________。
(2)铁在人类的生产和生活中有着十分重要的应用。铁的应用,经历了________到________到________的演变过程。
(3)某种复合材料具有耐高温、强度高、导电性好、导热性好的特点,估计该复合材料的基体和增强体材料可能分别是( )
A.金属;碳纤维 B.陶瓷;SiO2
C.合成树脂;SiO2、Al2O3、MgO D.合成树脂;碳纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是( )
A.定容时俯视液面 B.转移溶液前溶液未冷却至室温
C.容量瓶未干燥 D.未洗涤烧杯和玻璃棒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com