
����Ŀ���л���A���������Ƿ��͵õ���Ҳ���Դ�ţ������ȡ��������AΪ��ɫճ��Һ�壬������ˮ��Ϊ�о�A�������ṹ������������ʵ�飺
ʵ�鲽�� | ���ͻ�ʵ����� |
(1)��ȡA9.0g������ʹ�������������ܶ�����ͬ������H2��45 ���� | (1)A����Է�������Ϊ��_____________�� |
(2)��9.0gA��������O2�г��ȼ�գ���ʹ��������λ���ͨ��Ũ���ᡢ��ʯ�ң��������߷ֱ�����5.4g��13.2g�� | (2)A�ķ���ʽΪ��______________�� |
(3)��ȡA9.0g����������NaHCO3��ĩ��Ӧ������2.24LCO2(��״��)���������������Ʒ�Ӧ������2.24 L H2(��״��)�� | (3)�ýṹ��ʽ��ʾA �к��еĹ�����__________�� |
(4)A�ĺ���������������ͼ��
| (4)A�к���������ԭ�ӡ� |
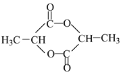
(5)����������A �Ľṹ��ʽΪ__________, д��������A����ȥ������ˮ�γ�һ����Ԫ��״������Ļ�ѧ����ʽ_______________________________________ (6)A�ж���ͬ���칹�壬����һ���ܷ���������Ӧ��1mol����ͬ���칹���������Ľ����Ʒ�Ӧ����1molH2�������ͬ���칹��Ľṹ��ʽΪ ____________�� | |
���𰸡�90 C3H6O3 -COOH��-OH ![]() 2
2![]() ��
��  +2H2O CH2(OH)CH(OH)CHO
+2H2O CH2(OH)CH(OH)CHO
��������
(1)��ͬ�����£��������Է�������֮�ȵ����ܶ�֮�ȣ�
(2)Ũ�����������ˮ����ʯ�ҿ������ն�����̼������Ԫ���غ���ȷ���л���ķ���ʽ��
(3)�Ȼ����Ժ�̼�����Ʒ�����ѧ��Ӧ���ɶ�����̼���Ȼ����ǻ����Ժͽ����Ʒ�����ѧ��Ӧ����������
(4)(5)�˴Ź�������ͼ���м�����ֵ���м������͵ĵ�Ч��ԭ�ӣ������֮�ȵ�����ԭ�ӵ���Ŀ֮�ȣ���ϣ�3����֪A�Ľṹ��ʽ��A���Ӽ���ˮ���ɻ�����ˮ��
(6)A�ж���ͬ���칹�壬����һ���ܷ���������Ӧ��˵������ȩ����1mol����ͬ���칹���������Ľ����Ʒ�Ӧ����1molH2��˵�����л�����ӽṹ����2���ǻ���
(1)A���ܶ�����ͬ������H2��45��������A����Է�������Ϊ��45��2=90��
(2)n��A��=9g��90g/mol=0.1mol��Ũ��������5.4g��������ˮ��������5.4g������ˮ�����ʵ�����![]() =0.3mol����������ԭ�ӵ����ʵ�����0.6mol����ʯ������13.2g���������ɶ�����̼��������13.2g���������ɶ�����̼�����ʵ�����
=0.3mol����������ԭ�ӵ����ʵ�����0.6mol����ʯ������13.2g���������ɶ�����̼��������13.2g���������ɶ�����̼�����ʵ�����![]() =0.3mol������̼ԭ�ӵ����ʵ�����0.3mol��n��A����n��C����n��H��=0.1mol��0.3mol��0.6mol=1:3:6������1��A������̼ԭ������3����ԭ������6��������Է���������90��������ԭ������3��������ʽΪC3H6O3��
=0.3mol������̼ԭ�ӵ����ʵ�����0.3mol��n��A����n��C����n��H��=0.1mol��0.3mol��0.6mol=1:3:6������1��A������̼ԭ������3����ԭ������6��������Է���������90��������ԭ������3��������ʽΪC3H6O3��
(3) n��A��=9g��90g/mol=0.1mol��ֻ���Ȼ����Ժ�̼�����Ʒ�����ѧ��Ӧ���ɶ�����̼������2.24LCO2(��״��)��n��CO2��=2.24L��22.4L/mol=0.1mol����1��A�к���һ���Ȼ����Ȼ����ǻ����Ժͽ����Ʒ�����Ӧ���������������������Ʒ�Ӧ������2.24LH2(��״��)��n��H2��=2.24L��22.4L/mol=0.1mol����1��A�к���1���ǻ����ʴ�Ϊ-COOH��-OH��
(5)A�ķ���ʽΪC3H6O3����(4)��֪��ԭ�ӵĸ�������3��1��1��1����ϣ�3���й����ţ�A�Ľṹ��ʽΪ![]() ��������A����ȥ������ˮ�γ�һ����Ԫ��״������Ļ�ѧ����ʽΪ��2
��������A����ȥ������ˮ�γ�һ����Ԫ��״������Ļ�ѧ����ʽΪ��2![]() ��
��  +2H2O��
+2H2O��
(6)A�ж���ͬ���칹�壬����һ���ܷ���������Ӧ��˵������ȩ����1mol����ͬ���칹���������Ľ����Ʒ�Ӧ����1molH2��˵�����л�����ӽṹ����2���ǻ��������ͬ���칹��Ľṹ��ʽΪCH2(OH)CH(OH)CHO��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ������ͼ��ʾװ����Ũ��������Ƿ�Ӧ��ʵ�顣�����й�ʵ������������������( )

A.��A�з�Һ©������������Ũ���ᣬ��ַ�Ӧ����ƿ�ڳ��ֺ�ɫ����
B.Ʒ����Һ��ɫ��ȥ��֤����SO2��������
C.����A�в����������к���ˮ������Ӧ��E����A��B֮��
D.D����Һ����ǣ�����֤����Ӧ������CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ӻ�����Ľṹ��ͼ��ʾ������W��X��Y��Z��ԭ��������������Ķ���������Ԫ�أ�W���������Y��������۴�����Ϊ0��X��Zͬ���塣����˵������ȷ����
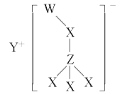
A.Y��Z��ɵĻ�����ˮ��Һ�ʼ���B.ԭ�Ӱ뾶��С��Z>Y>X>W
C.W��Y��ɵĻ�������ǿ��ԭ��D.����⻯����ȶ��ԣ�X>Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ܱ������еķ�Ӧ2SO3(g)O2(g)��2SO2(g)����һ��������n(SO3)��n(O2)��ʱ��仯�Ĺ�ϵ��ͼ��ʾ������������ȷ���ǣ� ��
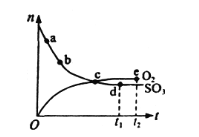
A.��c����Ӧ�ﵽƽ��
B.��b������Ӧ���ʱȵ�a�Ĵ�
C.��e�淴Ӧ����Ϊ0
D.һ���¶��£�2SO3(g) O2(g)��2SO2(g)�ں����ܱ������н��У�����He��ѹǿ����ѧ��Ӧ���ʲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵���������
A.��״���£�������Ȼ�ϵ�������һ����̼���干8.96L�������������г��ȼ��ʱ���������ķ�����Ϊ0.2NA
B.�ö��Ե缫�������ͭ��Һʱ������Һ��pHֵ��Ϊ1ʱ����缫��ת�Ƶĵ�����ĿΪNA
C.32.5 gп��һ����Ũ����ǡ����ȫ��Ӧ����������ķ�����Ϊ0.5NA
D.��Ӧ3H2(g)��N2(g)![]() 2NH3(g)����H����92 kJ��mol��1�����ų�����9.2 kJʱת�Ƶ���0.6NA
2NH3(g)����H����92 kJ��mol��1�����ų�����9.2 kJʱת�Ƶ���0.6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶�ΪTʱ����2.0 L�����ܱ������г���1.0 mol PCl5��������Ӧ��PCl5(g)![]() PCl3(g)��Cl2(g)����H=a kJ��mol��1(a��0)��0��10 min���������¶Ȳ��䣬10 minʱ�ı�һ������������������PCl5��PCl3��Cl2�����ʵ�����ʱ��ı仯��ͼ��ʾ��
PCl3(g)��Cl2(g)����H=a kJ��mol��1(a��0)��0��10 min���������¶Ȳ��䣬10 minʱ�ı�һ������������������PCl5��PCl3��Cl2�����ʵ�����ʱ��ı仯��ͼ��ʾ��
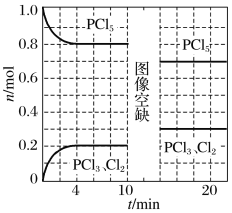
����˵����ȷ����
A.0��4 min��ƽ������v(PCl3)=0.025 mol��L��1��min��1
B.10 minʱ�ı��������������һ������PCl5
C.����ʼʱ��������г���2.0 mol PCl3��2.0 mol Cl2�������¶�ΪT����Ӧ��ƽ��ʱ�ų�������С��1.6a kJ
D.�¶�ΪT����ʼʱ��������г���1.0 mol PCl5��0.10 mol PCl3��0.10 mol Cl2����Ӧ�ﵽƽ��ǰv����v��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ャҺ����Al(OH)3��MnO2������Na2CrO4�����ǵ��������������ʹNa2CrO4������ȫ��ˮ������ij�о�С��������Ƶĵ�����װ�ã���ͼ����ʹ��Һ����ɹ�������ͺ���Ԫ����Һ�����������á��ش��������е����⡣
![]()
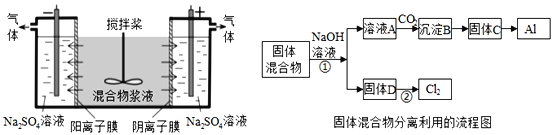
������������ķ�������ã�����ͼ�еIJ��ַ�������ͷ�Ӧ����δ������
��1��C��Al���Ʊ�������Ϊ��ⷨ����д��������Ӧ����ʽ_____________________��
��2����С��̽����Ӧ��������������D��Ũ�����ϣ��������ޱ仯��������Cl2���ɣ�����Ӧֹͣ������ʣ�࣬��ʱ�μ����ᣬ�ֲ���Cl2���ɴ��ж�Ӱ��÷�Ӧ��Ч���е������У�����ţ�_____��
A���¶� B����Һ��pHֵ C��Cl-��![]() -��Ũ��
-��Ũ��
��3������D�Ǽ���п�̵�ص���������д���õ�صĸ�����Ӧ����ʽ_____________ ��
��4��0.2molCl2�뽹̿��TiO2��ȫ��Ӧ������CO��TiCl4���۵�-25��,�е�136��4��������8.56kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ______________________________________��
��������Ԫ����Һ�ķ��������
��5���ö��Ե缫���ʱ��![]() �ܴӽ�Һ�з��������ԭ����_________________��
�ܴӽ�Һ�з��������ԭ����_________________��
�����õ��ĺ���Ԫ�ص�������![]() ����
����![]() ����ԭ����__________________________(�����ӷ�Ӧ����ʽ��ʾ)�����������ɵ�����Ϊ_____________��д��ѧʽ����
����ԭ����__________________________(�����ӷ�Ӧ����ʽ��ʾ)�����������ɵ�����Ϊ_____________��д��ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ijЩ�������ȡ���ռ���β������װ����ͼ��ʾ��ʡ�Լгֺ;���װ�ã������ô�װ�úͱ����ṩ������������ʵ�飬�������ѡ����

ѡ�� | a�е����� | b�е����� | c���ռ������� | d�е����� |
A | Ũ��ˮ | CaO | NH3 | H2O |
B | ϡ���� | Na2SO3 | SO2 | NaOH��Һ |
C | ϡ���� | Cu | NO2 | H2O |
D | Ũ���� | KMnO4 | Cl2 | NaOH��Һ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǵ��CuCl2��Һ��װ�ã�����c��dΪʯī�缫���������йص��ж���ȷ����(����)
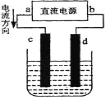
A. �������У�d�缫��������
B. a������b����
C. a������b����
D. �������У�������Ũ�Ȳ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com