
分析 发生反应为Fe+2H+=Fe2++H2↑、2Al+6H+=2Al3++3H2↑,
(1)计算盐酸浓度的变化,再根据n=cV计算消耗HCl的物质的量;
(2)设Al、Fe的物质的量分别为x、y,根据二者质量之和、电子转移守恒列方程计算解答;
(3)根据H原子守恒计算生成氢气的物质的量,再根据V=nVm计算氢气的体积.
解答 解:(1)盐酸的浓度变化为:5mol/L-4.6mol/L=0.4mol/L,
消耗HCl的物质的量为:n(HCl)=0.2L×0.4mol/L=0.08mol,
答:反应中消耗HCl的物质的量为0.08mol;
(2)设Al、Fe的物质的量分别为x、y,根据二者质量、电子转移守恒有:27x+56y=1.1、3x+2y=0.08,
解得:x=0.02mol、y=0.01mol,
答:该混合物中铝、铁的物质的量分别为0.02mol、0.01mol;
(3)根据氢原子守恒可知n(H2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.08mol=0.04mol,
则生成标准状况下氢气的体积为:V(H2)=0.04mol×22.4L/mol=0.896L,
答:产生的标准状况下气体的体积为0.896.
点评 本题考查混合物的有关计算,题目难度中等,明确发生反应的实质为解答关键,可以利用关系式计算氢气的物质的量,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
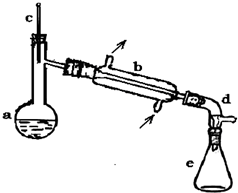 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应 和实验装置如图:
和实验装置如图:| 相对分子质量 | 密度/(g?cm-3 ) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的 2 mol/L的硫酸于试管 | 反应速率:镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活性炭、氯气都能使品红溶液褪色 | |
| B. | 苯、乙醇、纤维素都能与浓硝酸反应 | |
| C. | 乙烯、氯乙烯都能使溴水褪色 | |
| D. | 淀粉、蛋白质都能发生显色(或颜色)反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1 mol水的体积约为22.4L | |
| B. | 只有在标准状况下,气体的摩尔体积才是22.4mol/L | |
| C. | 在标准状况下,1molH2和O2的混合气体体积约为22.4 L | |
| D. | 任何条件下,气体的摩尔体积都是22.4L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的结构简式: | B. | 乙醇的结构式:CH3CH2OH | ||
| C. | 四氯化碳分子的电子式为: | D. | 丙烷分子的球棍模型为: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com