
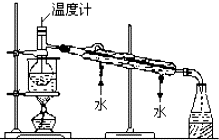
 海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.某研究性学习小组设计如下实验从海带中提取碘,请你完成下面相关问题:
海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.某研究性学习小组设计如下实验从海带中提取碘,请你完成下面相关问题:分析 (1)根据实验操作步骤①灼烧来分析用到的实验仪器;
(2)过氧化氢在酸溶液中氧化碘离子为单质碘;
(3)含碘离子溶液通入适量Cl2是为了将碘离子氧化成单质碘,离子方程式为2I?+Cl2=I2+2Cl-;
(3)操作⑤是利用溶解度不同,对碘单质萃取分液,利用碘易溶于有机溶剂的性质来进行提取,须注意:选择的能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离;
(4)分析装置图可知,最后晶体碘在蒸馏烧瓶这聚集为固体,烧杯加热应垫石棉网,温度计水银球应位于蒸馏烧瓶支管口处,冷凝管冷凝水下进上出.
解答 解:(1)步骤①是固体灼烧,灼烧固体物质一般使用(瓷)坩埚,而坩埚加热需要用泥三脚支撑然后放在三脚架上,三脚架下面的空间放酒精灯.
故答案为:灼烧;坩埚、酒精灯、泥三角;
(2)将含碘离子溶液中加入氧化剂是为了将碘离子氧化,过氧化氢在酸溶液中氧化成单质碘,离子方程式为2I-+H2O2+2H+=I2+2H2O,
故答案为:2I-+H2O2+2H+=I2+2H2O;
(3)操作⑤是将碘水转化为含碘的有机溶液,需用对卤素单质溶解能力强的有机溶剂把碘从碘水中提取出来,对应进行的实验操作是萃取,利用碘易溶于有机溶剂的性质来进行提取,利用碘易溶于有机溶剂的性质来进行提取,须注意:选择的能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离,符合条件的是四氯化碳,酒精、乙酸、蔗糖都易溶于水,不能分层,
故答案为:萃取分液;B;
(4)碘单质易升华,冷却后晶体碘在蒸馏烧瓶这聚集为固体,烧杯是大面积加热的玻璃仪器,加热应垫石棉网,温度计是为了测定流出成分的沸点,水银球应位于蒸馏烧瓶支管口处,冷凝管冷凝水遵循逆流方向,即下进上出,这样冷凝效果好,
故答案为:蒸馏烧瓶;温度计水银球应位于蒸馏烧瓶支管口处;烧杯加热时没有使用石棉网;冷凝管冷却水应该从下管进上管出.
点评 本题考查制备实验方案的设计,题目难度中等,注意基本实验操作的要点和注意事项.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a(A)>a′(A) a(B)<a′(B) | B. | a(A)>a′(A) a(B)=a′(B) | C. | a(A)<a′(A) a(B)<a′(B) | D. | a(A)=a′(A) a(B)>a′(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成n mol的AB的同时,生成n mol的A2 | |
| B. | 单位时间内生成n mol A2的同时,生成n mol的B2 | |
| C. | 容器内的总压强不随时间而变化 | |
| D. | 单位时间内生成2n mol AB的同时,生成n mol的B2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,11.2LCI2含有的分子数为NA | |
| B. | 32gO2中所含有的氧原子数为NA | |
| C. | 2.4g镁变成镁离子,转移的电子数为0.2NA | |
| D. | 1L0.3mol/LK2SO4溶液中含有的K+数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)4]溶液,观察铁钉周围出现蓝色沉淀的快慢 | |
| B. | 受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 | |
| C. | 实验室用已知浓度的酯酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞做指示剂比用甲基橙做指示剂时带来的误差要大一点 | |
| D. | 自来水厂常用某些含铝或铁的化合物作净水剂,是由于它们具有杀菌作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Z、W分别与Y形成的常见化合物均为碱性氧化物 | |
| B. | X和R形成的常见化合物中各原子都达到8电子稳定结构 | |
| C. | 离子半径的大小顺序为:Z+>W2+>Y2- | |
| D. | 含有Y、Z、R三种元素的化合物最多只有3种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com