
| A. | CaCO3→CO2 | B. | Cl2→HClO | C. | Na→Na+ | D. | Fe3+→Fe2+ |
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
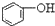 >HCO3-,下列化学方程式正确的是( )
>HCO3-,下列化学方程式正确的是( )| A. | 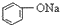 +H2O+CO2→ +H2O+CO2→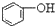 +Na2CO3 +Na2CO3 | B. | 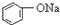 +NaHCO3→ +NaHCO3→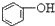 +Na2CO3 +Na2CO3 | ||
| C. | 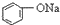 +H2O+CO2→ +H2O+CO2→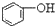 +NaHCO3 +NaHCO3 | D. | 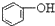 +NaHCO3→ +NaHCO3→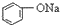 +H2O+CO2 +H2O+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br2和HBrO3均是氧化产物 | |
| B. | BrF3既是氧化剂,又是还原剂 | |
| C. | BrF3的氧化性强于O2 | |
| D. | 反应中,若生成1molBr2,则反应转移6NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
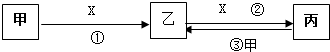
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能kJ/mol | 436 | 565 | 431 | 368 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
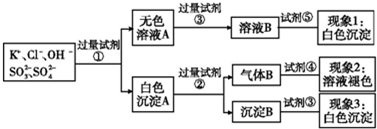
| A. | 试剂③是AgNO3溶液,试剂⑤是稀硝酸,现象1中白色沉淀是AgCl | |
| B. | 现象3中白色沉淀是BaSO4 | |
| C. | 产生现象2的离子方程式是:Br2+2H2O+SO2═4H++2Br-+SO42- | |
| D. | 试剂②是稀盐酸,试剂③是稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
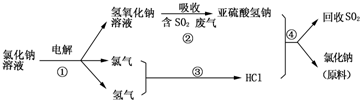
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com