
| A. | 把CO2通入CaCl2溶液中,有CaCO3沉淀生成 | |
| B. | 把SO2通入Ca(NO3)2溶液中,有CaSO3沉淀生成 | |
| C. | 把CO2通入Ca(ClO)2溶液中,有CaCO3沉淀生成,说明酸性:H2CO3>HClO | |
| D. | 把SO2通入Ca(ClO)2溶液中,有CaSO3沉淀生成,说明酸性:H2SO3>HClO |
分析 A.盐酸酸性大于碳酸,二氧化碳和氯化钙溶液不发生反应;
B.二氧化硫具有还原性,酸溶液中硝酸根离子具有氧化性,氧化二氧化硫为硫酸,结合钙离子生成微溶于水的硫酸钙;
C.强酸制备弱酸;
D.二氧化硫具有还原性,次氯酸根离子具有氧化性,能把二氧化硫氧化为硫酸;
解答 解:A.盐酸酸性大于碳酸,二氧化碳和氯化钙溶液不发生反应,不能生成沉淀,故A错误;
B.酸溶液中硝酸根离子具有氧化性,氧化二氧化硫为硫酸,结合钙离子生成微溶于水的硫酸钙,故B错误;
C.强酸制备弱酸,把CO2通入Ca(ClO)2溶液中,有CaCO3沉淀生成,说明酸性:H2CO3>HClO,故C正确;
D.少量SO2通入Ca(ClO)2溶液中的离子反应为SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故D错误;
故选C.
点评 本题考查了物质性质,反应规律的分析应用,主要是二氧化碳、二氧化硫气体性质的理解,注意次氯酸根离子的氧化性,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在常温下,向 0.01mol?L-1 的 NH4HSO4 溶液中滴加 NaOH 溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH- )=c(H+) | |
| B. | 25℃时,在 0.1mol?L-1 的 NaHSO4 溶液中,c(H+)=c(OH- )+c(SO42-) | |
| C. | 浓度均为 0.1mol?L-1 的 HF 溶液和 KF 溶液等体积混合:c(F-)+c(HF)=0.2mol/L | |
| D. | 均为 0.1mol?L-1 的 Na2S 溶液和 NaHS 溶液等体积混合:2c(Na+)=3c(HS-)+3c(H2S)+3c(S2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.6g乙醇与足量的钠反应放出1.12L氢气 | |
| B. | 可用苯或大豆油从溴水中萃取溴 | |
| C. | 0.1mol丙烷中含有约6.02×1023个共价键 | |
| D. | 分子式为C4H9Cl的有机物共有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
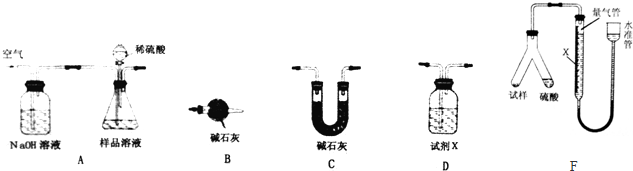
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与氧气 | B. | 澄清石灰水与二氧化碳 | ||
| C. | 氯化铝溶液与氢氧化钠溶液 | D. | Al与稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述实验证明氧化性:MnO4->Cl2>Fe3+ | |
| B. | 上述实验中,有一个氧化还原反应 | |
| C. | 实验①生成的气体需要进行尾气处理 | |
| D. | 实验②证明Fe2+既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com