
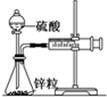
 某温度下按如图安装好实验装置,在锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol?L-1的硫酸,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL),在该温度下,下列说法不正确的是( )
某温度下按如图安装好实验装置,在锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol?L-1的硫酸,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为50mL(若折合成0℃、101kPa条件下的H2体积为44.8mL),在该温度下,下列说法不正确的是( )| A、用锌粒表示10 s内该反应的速率为0.013 g?s-1 |
| B、忽略锥形瓶溶液体积的变化,用H+来表示10 s该反应的速率0.01 mol?(L?s)-1 |
| C、忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内反应的速率0.01 mol?(L?s)-1 |
| D、用H2表示10 s内该反应的速率为0.004 mol?(L?s)-1 |
| △c |
| △t |
| 0.13g |
| 10s |
| ||
| 10s |
| 1 |
| 2 |
| ||||
| 10s |


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,其中取代基-Y中不含支链,含有碳碳双键,咖啡酸有如下转化关系:
,其中取代基-Y中不含支链,含有碳碳双键,咖啡酸有如下转化关系:
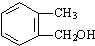 ,试写出D的属于芳香醇的其中2种同分异构体是
,试写出D的属于芳香醇的其中2种同分异构体是查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 实验步骤 | 预期现象与结论 |
| 步骤I:取少量样品于一支试管中,向其中加入适量 ,塞上带导管的单孔塞,将导管另一端插入盛有足量 的试管中 | |
| 步骤II: |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com