
【题目】有机物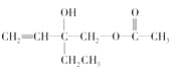 具有手性,发生下列反应后,分子仍有手性的是( )
具有手性,发生下列反应后,分子仍有手性的是( )
①与H2发生加成反应 ②与乙酸发生酯化反应 ③发生水解反应 ④发生消去反应
A. ①② B. ②③ C. ①④ D. ②④
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】关于下图所示转化关系(X代表卤素),说法不正确的是
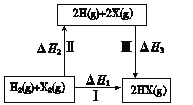
A.2H(g) +2X(g) = 2HX(g) ΔH3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3
C.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
D.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
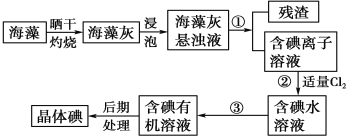
(1)实验室焙烧海带,需要下列仪器中的________(填序号)。
a 试管 b 烧杯 c 坩埚 d 泥三角 e 铁三脚架 f 酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①__________,③________。
(3)提取碘的过程中,可选择的有机试剂是(_______)
A 甲苯、酒精 B 四氯化碳、苯
C 汽油、乙酸 D 汽油、甘油
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有__________、__________。
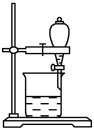
(5)小组用CCl4萃取碘水中的碘,在右图的分液漏斗中,下层液体呈__________色;
(6)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
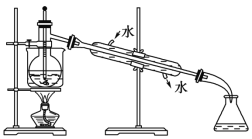
①____________________;
②_______________________________;
③____________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BMO(Bi2MoO6)是种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法错误的是
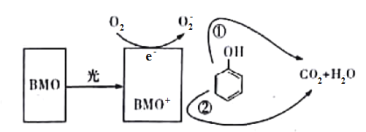
A.该过程的总反应为:C6H6O+ 7O2![]() 6CO2+3H2O
6CO2+3H2O
B.该过程中BMO+表现出较强的氧化性
C.①和②中被降解的苯酚的物质的量之比为1:3
D.光催化降解过程中,光能转化为化学能、热能等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(结构式如图所示)是常用的还原剂,由H·C·Brown和Schlesinger于1942年在芝加哥大学发现。其中X、Y、Z是原子序数依次减小的不同短周期主族元素,X与W、Z与W均能形成原子个数比为1:1和2:1的化合物,W原子的最外层电子数是电子层数的3倍。下列叙述正确的是
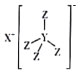
A.Z元素位于第三周期第Ⅶ A族
B.Y的最高价氧化物对应的水化物是一种一元弱酸
C.X和Z形成的化合物的水溶液呈酸性
D.化合物M不能与Z2W2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是 ( )

A.通电后中间隔室的SO42-向阳极迁移,阳极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.阴极反应为4OH--4e-=O2↑+2H2O,阴极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有11.2L O2生成(标况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知研究氮及其化合物的转化对于环境改善有重大意义。
I.已知N2(g) +O2(g)=2NO(g) △H=+180.4 kJ/mol,
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H=![]() kJ/mol。
kJ/mol。
(1)用NH3消除NO污染的反应为:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H=_______。则该反应自发进行的条件是______________(填“高温”或“低温”)。
5N2(g)+6H2O(l) △H=_______。则该反应自发进行的条件是______________(填“高温”或“低温”)。
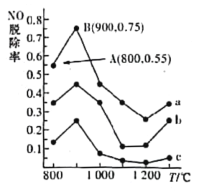
(2)不同温度条件下,NH3与NO的物质的量之比分别为4:1、3:1、1:3,得到NO脱除率曲线如图所示。曲线a中NH3的起始浓度为4×10- 5mol/L,从A点到B点经过2秒,该时间段内NO的脱除速率为_______mg/(L·s),在AB所在的曲线上当温度高于900℃时NO脱除率明显降低的原因是_______________________________________________。
Ⅱ.用活性碳还原法也可以处理氮氧化合物,发生的反应为2CO(g)+ 2NO(g)![]() N2(g)+2CO2(g) △H=-746.8kJ/mol。
N2(g)+2CO2(g) △H=-746.8kJ/mol。
(3)在一恒容绝热的密闭容器中,能表示上述反应达到平衡状态的是_____________(填字母代号)。
A.单位时间内断裂1 mol N≡N键的同时生成2 mol C=O键
B.容器内的总压强保持不变
C.混合气体的密度保持不变
D.c(NO):c(N2):c(CO2)=2:1:2
E.混合气体的平均摩尔质量保持不变
(4)向一恒容密闭容器中充入3mol CO和2mol NO,测得气体的总压为10MPa,在一定温度下开始反应,10 min后达到平衡,测得NO的转化率为75%,该反应的平衡常数KP=____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅲ.用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。
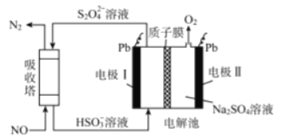
(5)写出吸收塔中的离子反应方程式_____________________________________,反应过程中若通过质子交换膜的H+为1 mol时,吸收塔中生成的气体在标准状况下的体积为_____ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)二氯化二硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a.S2Cl2分子中所有原子都满足8电子稳定结构,写出它的电子式____________;
b.指出它分子内的键型_________。
(2)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___________。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是________(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某原子结构示意图为 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
A. 结构示意图中x=4
B. 该原子的电子排布式为1s22s22p63s23p4
C. 该原子的电子排布图为![]()
D. 该原子结构中共有5个能级上填充有电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com