
| A. | 除去KCl中混有的KI:溶于水通入过量氯气,蒸发结晶 | |
| B. | 除去BaSO4固体中混有的BaCO3:加过量盐酸后,过滤 | |
| C. | 除去Na2CO3固体中的NaHCO3:加热至恒重 | |
| D. | 除去CO2中混有的HCl:将气体通过饱和Na2CO3溶液 |
分析 A.KI能和氯气反应生成碘和KCl,碘易升华;
B.BaSO4不溶于水和稀盐酸,BaCO3和稀盐酸反应生成可溶性的BaCl2;
C.Na2CO3较稳定,受热不易分解,NaHCO3不稳定,受热易分解生成Na2CO3;
D.CO2、HCl都和饱和的Na2CO3溶液反应.
解答 解:A.KI能和氯气反应生成碘和KCl,碘易升华,将混合物溶于水通入过量氯气,蒸发结晶,生成的碘升华、氯气逸出,所以得到纯净的KCl,故A正确;
B.BaSO4不溶于水和稀盐酸,BaCO3和稀盐酸反应生成可溶性的BaCl2,然后过滤得到纯净的BaSO4,故B正确;
C.Na2CO3较稳定,受热不易分解,NaHCO3不稳定,受热易分解生成Na2CO3,所以除去Na2CO3固体中的NaHCO3采用加热方法,故C正确;
D.CO2、HCl都和饱和的Na2CO3溶液反应,所以不能用饱和的碳酸钠溶液除去二氧化碳中的HCl,应该用饱和的碳酸氢钠溶液除去HCl,故D错误;
故选D.
点评 本题考查除杂,为高频考点,明确物质差异性是解本题关键,注意物质性质及分离提纯方法的选取,除杂时不能引进新的杂质且操作要简便.


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 向水中加人稀氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 向水中加人少量固体NaCl,平衡逆向移动,c(H+)降低 | |
| D. | 将水加热,Kw增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中一定有氧元素参与 | |
| B. | 氧化还原反应中所有元素化合价都变化 | |
| C. | 氧化还原反应只有一种元素的化合价变化 | |
| D. | 氧化还原反应中电子有得必有失,化合价有升必有降 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
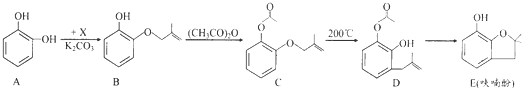
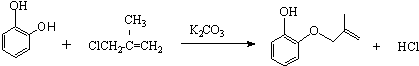 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
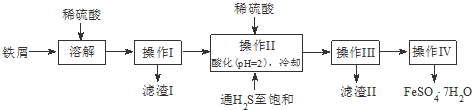
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{12}C$ 与${\;}_{\;}^{14}C$互为同素异形体 | |
| B. | 金刚石与石墨互为同位素 | |
| C. | 二甲醚与乙醇互为同分异构体 | |
| D. | 乙烷与乙烯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com