
【题目】如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: 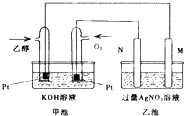
(1)M电极的材料是 , 电极名称是 , 加入乙醇的铂电极的电极反应式为 .
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为mL(标准状况下).
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量表示该反应的热化学方程式为 .
【答案】
(1)铁;阴极;C2H5OH﹣12e﹣+16OH﹣=2CO32﹣+11H2O
(2)224
(3)C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l),△H=﹣1366.7kJ/mol
【解析】解:(1)碱性乙醇燃料电池中通入乙醇的一极为原电池的负极,负极上乙醇失电子发生氧化反应,电极反应式为C2H5OH﹣12e﹣+16OH﹣=2CO32﹣+11H2O,通入氧气的一极为原电池的正极,电极反应式为:4OH﹣﹣4e﹣═2H2O+O2↑,乙池为电解池,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,应为电解池的阳极,则应为石墨材料,N为阳极,电极反应式是4OH﹣﹣4e﹣=O2↑+2H2O,M为阴极,电极材料是Fe, 所以答案是:铁;阴极;C2H5OH﹣12e﹣+16OH﹣=2CO32﹣+11H2O;(2)n(Ag)= ![]() =0.04mol,根据Ag++e﹣=Ag可知转移电子为0.04mol,甲池中通入氧气的一极为正极,反应式为2O2+8H++8e﹣=4H2O,则消耗n(O2)=
=0.04mol,根据Ag++e﹣=Ag可知转移电子为0.04mol,甲池中通入氧气的一极为正极,反应式为2O2+8H++8e﹣=4H2O,则消耗n(O2)= ![]() ×0.04mol=0.01mol,V(O2)=0.01mol×22.4L/mol=0.224L=224mL,
×0.04mol=0.01mol,V(O2)=0.01mol×22.4L/mol=0.224L=224mL,
所以答案是:224;(3)常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量表示该反应的热化学方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l),△H=﹣1366.7kJ/mol.
所以答案是:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l),△H=﹣1366.7kJ/mol.


科目:高中化学 来源: 题型:
【题目】甲、乙、丙三位同学分别做了以下三个实验.
实验一:草酸晶体(H2C2O4)和浓硫酸混合缓慢加热时,可发生如下反应:H2C2O4=CO2↑+CO↑+H2O.甲同学设计了如图1实验装置,用来制取干燥纯净的CO气体,并用生成的CO气体还原FexOy , 制取铁粉.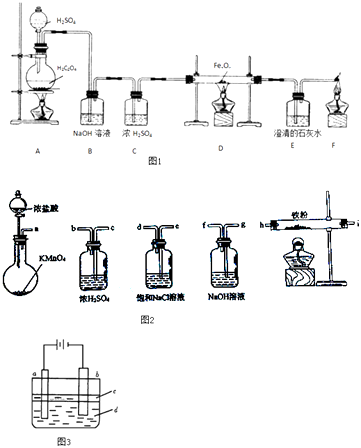
(1)装置B的作用是 . 装置E中的现象是 . 装置F的作用是 .
(2)若FexOy为0.4g,生成的气体与过量澄清石灰水反应生成0.75g白色沉淀,则FexOy的化学式为 .
实验二:乙同学用如图2所示仪器在实验室制备少量无水FeCl3 , 按气流由左到右顺序,仪器连接顺序的是 .
实验三:丙同学用如图3实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
①a电极材料为 , 其电极反应式为 .
②液体c为苯,其作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)某容器中发生了一个化学反应,反应过程中存在H2O、ClO﹣、CN﹣、HCO3﹣、N2、Cl﹣六种粒子,在反应过程中测得ClO﹣和N2的物质的量随时间变化的曲线如图所示. 
该反应的离子方程式是 .
(2)氮氧化合物是大气污染的重要盐因素,将NOx转化为无害物质是当前研究的重要课题.
①下式中X必须为无污染的物质,系数n可以为0.
NO2+G ![]() N2+H2O+nX(未配平的反应式).
N2+H2O+nX(未配平的反应式).
下列化合物中,满足上述反应式中的G是(填写字母).
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
②若G为天然气的主要成分,则X为 , n= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO47H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%). 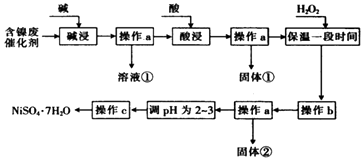
部分阳离子以氢氧化物形式沉淀时的pH如表:
沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
Al(OH)3 | 3.8 | 5.2 |
Fe(OH)3 | 2.7 | 3.2 |
Fe(OH)2 | 7.6 | 9.7 |
Ai(OH)2 | 7.1 | 9.2 |
(1)“碱浸”过程中发生反应的离子方程式是
(2)“酸浸”时所加入的酸是(填化学式).
(3)加入H2O2时发生反应的离子方程式为
(4)操作b为调节溶液的pH,你认为pH的调控范围是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题 I.某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验:
①取少量KI溶液于试管中,先加入溴水、振荡,再加入CCl4 , 振荡后静置,观察到下层液体呈紫红色;
②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈血红色.
(1)写出实验②中发生氧化还原反应的离子方程式: .
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是 .
A.Br2>I2
B.Fe3+>Br2
C.Br2>Fe3+
D.I﹣>Br﹣
(3)II.被誉为“江南小三峡”的南京胭脂河是明代初年开凿的一条人工运河.因其“石有胭脂色”而得名.胭脂河沿岸的那些红色石块的成分是什么?某研究性学习小组取一小块这种红色石块A,粉碎后对其成分进行实验探究,实验记录如图所示. 
请你根据使用推断:
A中含有的酸根离子(填离子符号).B中肯定含有的溶质是(写化学式).
写出实验中有关反应的化学方程式:
②
⑤ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有250mL浓度为2.0mol/L的硫酸和含1mol氢氧化钠的溶液,足量的铝屑.用上述原料生产Al(OH)3的量最多时消耗铝的质量为( )
A.26g
B.36g
C.104g
D.37.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H﹣1O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
B.充电时阳极反应为:Fe(OH)3﹣3e﹣+5 OH﹣═FeO ![]() +4H2O
+4H2O
C.放电时正极附近溶液的碱性增强
D.放电时负极反应为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度同体积的稀硫酸中 一段时间,以下叙述正确的是( ) 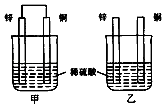
A.两烧杯中铜片表面均无气泡产生
B.两烧杯中溶液的pH均增大
C.甲中电子通过导线由锌片流向铜片,再回到锌片
D.乙中产生气泡的速度比甲快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com