
| A. | 分子数 | B. | 压强 | C. | 密度 | D. | 平均摩尔质量 |
分析 由2HBr(g)?H2(g)+Br2(g)-Q可知,为吸热反应,升高温度,平衡正向移动,但气体的质量、体积、物质的量不变,结合pV=nRT、ρ=$\frac{m}{V}$、M=$\frac{m}{n}$来解答.
解答 解:A.该反应前后气体的物质的量不变,则分子数不变,故A不选;
B.容积恒定,n不变,由pV=nRT可知,升高温度,压强增大,故B选;
C.m、V均不变,密度不变,故C不选;
D.m、n不变,则平均摩尔质量不变,故D不选;
故选B.
点评 本题考查阿伏伽德罗定律,为高频考点,把握反应的特点、阿伏伽德罗定律为解答的关键,侧重分析与应用能力的考查,注意判断反应中气体的物质的量关系,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
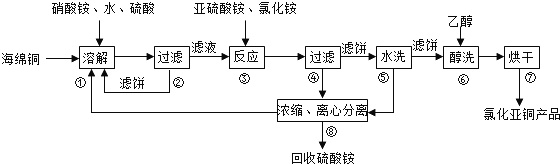
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=($\frac{10Q}{9}$-1366.8)kJ•mol-1 | |
| B. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+1366.8)kJ•mol-1 | |
| C. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=($\frac{10Q}{9}$-151.9)kJ•mol-1 | |
| D. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+151.9)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )| A. | 只有① | B. | 只有②④ | C. | 只有①②④ | D. | 只有①和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铷比镁金属性强 | |
| B. | 氯化镁比氯化铷难溶 | |
| C. | 高温下,镁离子得电子能力比铷离子弱 | |
| D. | 铷的沸点比镁低,当把铷蒸气抽走时,平衡向右反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-H | C═C | C-C | H-H |
| 键能/kJ•mol-1 | 414.4 | 615.3 | 347.3 | 435.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 946 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | B. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | H2S+Cl2=S+2HCl | D. | Cu2O+H2SO4=CuSO4+Cu+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com