
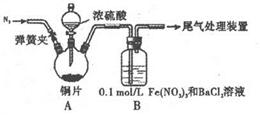
| A.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称貴 |
| B.将产生的气体缓缓通入酸性髙锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀 |
| C.用排水法测定其产生气体的体积(折算成标准状况) |
| D.用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况) |
 CuSO4+2H2O+2SO2↑(2分) ②AC(2分)
CuSO4+2H2O+2SO2↑(2分) ②AC(2分) CuSO4+2H2O+2SO2↑。
CuSO4+2H2O+2SO2↑。

科目:高中化学 来源:不详 题型:单选题

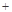 O2
O2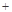 2H2SO4=2CuSO4
2H2SO4=2CuSO4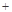 2H2O)
2H2O)| A.相对于途径①、③,途径②更好地体现了绿色化学思想 |
| B.途径③中,1mol Cu与足量浓硫酸反应会产生64g SO2气体 |
C.途径①所用混酸中H2SO4与HNO3物质的量之比最好为 |
D.1mol Cu分别按照途径②、③中,被还原的H2SO4的质量之比为 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通入Ca(ClO)2溶液中,有HClO生成 | B.通入FeCl3溶液中,有SO42-生成 |
| C.通入氯水中,有淡黄色沉淀生成 | D.通入KICl2溶液中,有I-生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫蒸气能跟氢气直接化合,硅和磷则不能 |
| B.硫蒸气能跟铜直接化合生成黑色的Cu2S |
| C.硫粉和汞即使不加热也能发生反应生成黑色的Hg2S |
| D.铁粉和硫粉混合加热发生反应后即使移去热源后反应还能继续 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫粉在过量的氧气中燃烧可以生成SO3 |
| B.可以用澄清石灰水鉴别CO2和SO2 |
| C.将少量CO2通入BaCl2溶液能生成白色沉淀 |
| D.不能用排水法收集SO2、NO2气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸可以作CO2、Cl2气体的干燥剂 |
| B.浓HNO3与金属反应时,HNO3常被还原为NO2 |
| C.实验室中浓硝酸要在棕色试剂瓶中密封保存,并放在阴凉处 |
| D.常温时,可以用铁制容器储存浓盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应后SO2有剩余 | B.溶液还可以吸收SO2 |
| C.溶液中除OH-外,只有一种阴离子 | D.溶液中溶质的物质的量之比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com