
| A、2I-+2Fe3+=I2+2Fe2+ |
| B、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| C、SO2+2H2O+I2=H2SO4+2HI |
| D、H2O2+H2SO4=SO2↑+O2↑+2H2O |


科目:高中化学 来源: 题型:
| c(H+) |
| c(HF) |
| c(H+)?c(F-) |
| c(HF) |
| A、①③④ | B、②③④ |
| C、③④⑤ | D、②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
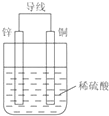 根据铜锌原电池示意图,回答下列问题:
根据铜锌原电池示意图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该原子的摩尔质量是:aNA | ||
B、Wg该原子的物质的量是:
| ||
C、Wg该原子中含有
| ||
D、由已知信息可得:NA=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它属于置换反应 |
| B、该反应中NH2-是还原产物 |
| C、该反应中NH3被氧化 |
| D、反应中被氧化和被还原的元素都是H元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L |
| B、0.3mol/L |
| C、0.05mol/L |
| D、0.03mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO42-浓度为3mol/L |
| B、Fe3+的质量为28g |
| C、Fe2(SO4)3浓度为1mol/L |
| D、SO42-为0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8 gNa2O2与足量的水反应,转移的电子数为0.1NA |
| B、用含有0.1molFeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1NA |
| C、25℃时,pH=13的1LBa(OH)2溶液中含有的OH-数为0.2NA |
| D、100mL 12 mol?L-1浓盐酸与足量MnO2加热反应,产生的氯气分子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com