
| A. | c(K+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+) | |
| B. | c(K+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol•L-1 | |
| D. | c(OH-)═c(H+)+2c(H2CO3)+c(HCO3-) |
分析 K2CO3为强碱弱酸盐,CO32-水解显碱性,且水解分步进行,溶液中遵循电荷守恒、物料守恒,以此来解答.
解答 解:A.CO32-水解显碱性,且水解分步进行,可知离子浓度为c(K+)>c(CO32-)>c(OH-)>c (HCO3-)>c(H+),故A正确;
B.由电荷守恒可知,c(K+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故B错误;
C.0.1mol•L-1K2CO3溶液中,由物料守恒可知c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol•L-1,故C正确;
D.由c(K+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)、c(K+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)],可知c(OH-)═c(H+)+2c(H2CO3)+c(HCO3-),故D正确;
故选B.
点评 本题考查离子浓度的比较,为高频考点,把握电荷守恒及物料守恒为解答的关键,侧重分析与应用能力的考查,注意水解原理的应用,题目难度不大.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有活泼金属与活泼非金属之间才能形成离子键 | |
| B. | 具有共价键的化合物是共价化合物 | |
| C. | 化学键是分子中多个原子之间强烈的相互作用 | |
| D. | 具有离子键的化合物是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键是一种作用力 | |
| B. | 化学键可以使原子相结合,也可以使离子相结合 | |
| C. | 化学反应过程中,反应物分子内的化学键断裂,产物分子内的化学键形成 | |
| D. | 极性键不是一种化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
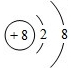 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大气雾霾污染现象的产生与汽车尾气排放有关 | |
| B. | 玻璃和氮化硅陶瓷都属于新型无机非金属材料 | |
| C. | 活性炭与二氧化硫都可用于漂白,其漂白原理相同 | |
| D. | 空气中的臭氧对人体健康有益无害 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
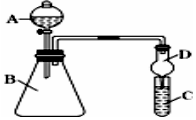 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
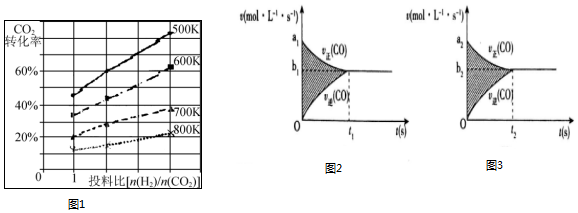
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ |
| 科学家 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
| 工作 | 发现“八音律”,指出从某一指定的元素起,第八个元素是第一个元素的某种重复 | 创立 近代原子论,率先开始相对原子质量的测定工作 | 发现了5组性质相似的“三元素组”,中间元素的相对原子质量为前后两种元素相对原子质量的算术平均值 | 认为 各元素组之间并非毫不相关,可以用相对原子质量把它们按从小到大的顺序串联 |
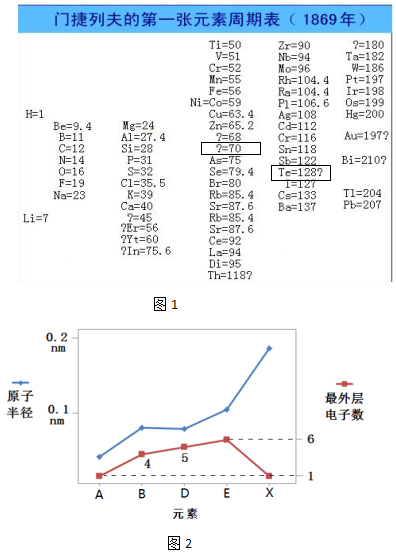
 ,写出Z元素气态氢化物的电子式:
,写出Z元素气态氢化物的电子式: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com