
【题目】碱式氯化铜[CuaClb(OH)c·xH2O]制备需要的CuCl2可用Fe3+作催化剂得到,其催化原理如图所示. 下列有关说法正确的是

A.a、b、c 之间的关系式为:a=b+c
B.图中M、N分别为Fe2+、Fe3+
C.若制备1 mol的CuCl2,理论上消耗11.2 LO2
D.N参加的反应离子方程式为:4Fe2++ O2+ 4H+ = 4Fe3+ + 2H2O
科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W是否位于同一周期(填“是”或“否”):__________,理由是________________。
(2)Y是_______,Z是_______,W是_______。
(3)X、Y、Z和W可组成一种化合物,其原子个数比为8∶2∶4∶1,写出该化合物的名称及化学式: _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 资源化利用的方法之一是合成二甲醚(
资源化利用的方法之一是合成二甲醚(![]() 简写做
简写做![]() )。
)。![]() 催化加氢法合成
催化加氢法合成![]() ,其过程中主要发生下列反应:
,其过程中主要发生下列反应:
反应Ⅰ:![]()
![]()
反应Ⅱ:![]()
![]()
其中,反应Ⅱ分以下两步完成,请写出反应Ⅳ的热化学方程式。
反应Ⅲ:![]()
![]()
反应Ⅳ:___________。
⑴反应Ⅳ的热化学方程式为________。
⑵在![]() 和
和![]() 的起始量一定的条件下,
的起始量一定的条件下,![]() 的平衡转化率和平衡时
的平衡转化率和平衡时![]() 、
、![]() 的选择性随压强或温度的变化见下图。已知:
的选择性随压强或温度的变化见下图。已知:
![]() 的选择性
的选择性![]() ;
;
![]() 的选择性
的选择性![]()
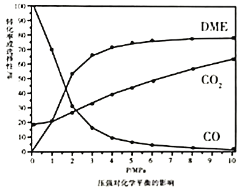
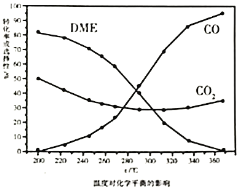
①依据图像中的数据分析,提高平衡时![]() 的选择性应当选择的条件为________。
的选择性应当选择的条件为________。
A 高温高压 B 低温低压 C 高温低压 D 低温高压
按照温度对化学平衡的影响图像分析温度低于300℃,![]() 平衡转化率随温度升高而降低的原因是_______。
平衡转化率随温度升高而降低的原因是_______。
②某温度和压强下,起始投入![]() 与足量
与足量![]() 发生反应,达到平衡时
发生反应,达到平衡时![]() 的转化率为40%,部分物质的物质的量如下表:
的转化率为40%,部分物质的物质的量如下表:
|
|
|
|
|
|
计算平衡时![]() 的选择性为________,反应Ⅳ的化学平衡常数为________。
的选择性为________,反应Ⅳ的化学平衡常数为________。
⑶经研究发现,在不同反应条件下反应相同时间(未平衡)测定发现,体系中![]() 的浓度均很低,则可知活化能大小关系:反应Ⅲ________反应Ⅳ(填“大于”、“小于”或“等于”)。
的浓度均很低,则可知活化能大小关系:反应Ⅲ________反应Ⅳ(填“大于”、“小于”或“等于”)。
⑷![]() ,投料比为
,投料比为![]() 时进行反应,
时进行反应,![]() 的浓度随时间变化如下图所示,则下列说法正确的为________。
的浓度随时间变化如下图所示,则下列说法正确的为________。
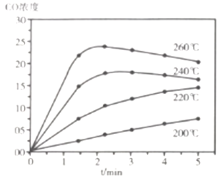
A 在![]() 范围内,反应Ⅰ的速率随温度升高而增大
范围内,反应Ⅰ的速率随温度升高而增大
B 200℃条件下,随反应时间的延长,![]() 的浓度始终增大
的浓度始终增大
C 260℃条件下,随反应时间的延长,![]() 的浓度先增大后减小最终不变
的浓度先增大后减小最终不变
D 260℃条件下,![]() 后
后![]() 的浓度减小是因为随时间推移反应Ⅱ的进行使体系中
的浓度减小是因为随时间推移反应Ⅱ的进行使体系中![]() 浓度越来越高,反应Ⅰ的逆反应速率不断增大,从而使
浓度越来越高,反应Ⅰ的逆反应速率不断增大,从而使![]() 浓度逐渐下降
浓度逐渐下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)![]() 2C(g) △H>0,其他条件不变,只有温度改变时,某量随温度变化的关系如图所示。则下列说法正确的是
2C(g) △H>0,其他条件不变,只有温度改变时,某量随温度变化的关系如图所示。则下列说法正确的是
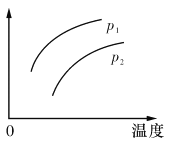
A.P1>P2,纵坐标可表示A的质量分数
B.P1<P2,纵坐标可表示C的质量贫数
C.P1>P2,纵坐标可表示混合气体的平均摩尔质量
D.P1<P2,纵坐标可表示A的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冠醚分子中有空穴 ,能够与金属离子形成稳定的络合物,该物质在有机工业中发挥着重要的作用。二环己烷并一18一冠一6(III )的制备原理如图,下列相关说法错误的是
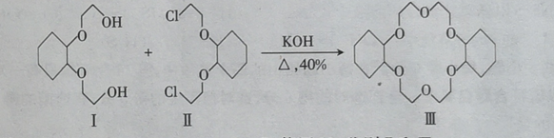
A.反应是取代反应B.能用Na鉴别I和III
C.I不能使酸性高锰酸钾溶液褪色D.III的一溴取代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
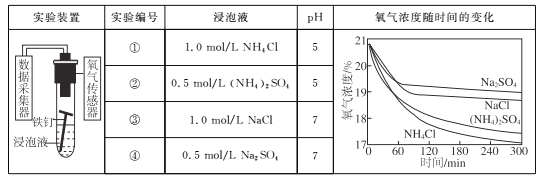
下列说法不正确的是
A. 上述正极反应均为O2+4e-+2H2O=4OH-
B. 在不同溶液中,Cl是影响吸氧腐蚀速率的主要因素
C. 向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快
D. 在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
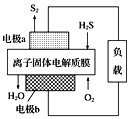
【题目】恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示[已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJ·mol-1:请回答下列问题:
2SO3(g) ΔH=-196.6kJ·mol-1:请回答下列问题:
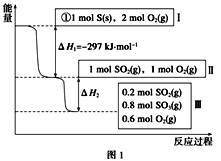
(1)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比|ΔH2|___(填“大”、“小”或“相等”)。
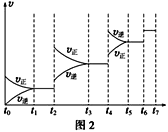
(2)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是___;图中表示平衡混合物中SO3的含量最高的一段时间是____。
(3)科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示。则电极b上发生的电极反应为___;电路中每通过4mol电子,在负极消耗___L(标况)气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+n(B)(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
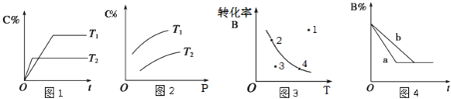
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n<p
C.图3中,表示反应速率v(正)>v(逆)的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,正确的是
A.平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物的物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物的物质的量时,平衡一定向正反应方向移动
B.已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率降低
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率降低
C.有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
D.有气体参加的反应达到平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com