
一定温度下,对固定容器中的可逆反应A(g)+2B(g)⇌3C(g)的下列叙述中,能说明反应已达到平衡的是( )(A、B为无色气体,C为有色气体)
|
| A. | 混合气体的物质的量不再变化 |
|
| B. | 单位时间内消耗amolA,同时生成3amolC |
|
| C. | 容器内的压强不再变化 |
|
| D. | 容器内气体颜色不再变化 |
| 化学平衡状态的判断.. | |
| 专题: | 化学平衡专题. |
| 分析: | 当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,注意该反应是一个反应前后气体体积不变的可逆反应. |
| 解答: | 解:A、反应前后气体体积不变,气体物质的量始终不变,所以混合气体物质的量不变不能说明达到平衡状态,故A错误; B、消耗A和生成C都是正向进行的反应,不能说明正逆反应速率相等,故B错误; C、反应前后气体体积不变,压强始终不变,所以混合气体压强不变不能说明达到平衡状态,故C错误; D、气体颜色不变,说明C的浓度不变,其他气体的浓度都不再变化,反应达到平衡状态,故D正确; 故选D. |
| 点评: | 本题考查化学平衡状态的判断,题目难度不大,本题注意化学平衡的特征,只有反应前后改变的物理量才能作为判断平衡状态的依据. |


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
下列反应中属于氧化还原反应,伹水既不作氧化剂又不作还原剂的是
A. SO3+H2O=H2SO4 B. Cl2+H2O=HCl+HClO
C. 2F2+2H2O=4HF+O2 D. 2Na+2H2O=2NaOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4NH3+5O2  4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是
4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是
A.v (NO)=0.02 mol·(L·s)-1 B.v (NO)=0.2mol·(L·s)-1
C.v (NH3)=0.01 mol·(L·s)-1 D.v (NH3)=0.1 mol·(L·s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
化学理论在元素单质及其化合物反应中应用广泛。
(1)在一定条件下,可逆反应mA nB+pC ⊿H,达到平衡状态。
nB+pC ⊿H,达到平衡状态。
①若A、B、C都是气体,增大压强,平衡向逆反应方向移动,则m (填“大于”、“小于”或“等于”)n+p。
②其他条件不变,加热后A的质量增加,则反应⊿H________0(填“大于”、“小于”或“等于”)。
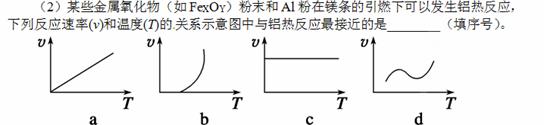 (3)一定温度下,发生反应:FeO(s)+CO(g)
(3)一定温度下,发生反应:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH。已知该反应在不同温度下的平衡常数如下表:
Fe(s)+CO2(g) ΔH。已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
请回答下列问题:
①该反应的ΔH___ 0(填“>”、“<”或“=”)。
②T℃时,将FeO(s)和CO(g)各3.0 mol加入10 L的密闭容器中,反应达到平衡后,测得CO转化率为W1,c(CO2) =0.15mol·L-1,则温度T (填“高于”、“低于”、“等于”)1000, 若此时保持其它条件不变再充入2.0 mol CO(g),再达平衡时测得CO转化率为W2,则W1 (填“>”、“<”或“=”)W2。
查看答案和解析>>
科目:高中化学 来源: 题型:
在温度不变下,在恒压容器a与恒容容器b中,分别充入体积比为1:3的N2和H2.若开始时两容器的体积相等,且在相同条件下达到平衡时,两容器中N2的转化率应当是( )
|
| A. | a中大 | B. | b中大 | C. | a、b一样大 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)═2C3H5(ONO2)3(l)△H1
2H2(g)+O2(g)═2H2O(g)△H2
C(s)+O2(g)═CO2(g)△H3
则反应4C3H5(ONO2)3(l)═12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为( )
|
| A. | 12△H3+5△H2﹣2△H1 | B. | 2△H1﹣5△H2﹣12△H3 | C. | 12△H3﹣5△H2﹣2△H1 | D. | △H1﹣5△H2﹣12△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
分类是化学学习与研究的常用方法,下列分类正确的是
A.Na2O2、MgO、Al2O3均属于碱性氧化物
B.纯碱、烧碱、熟石灰均属于碱
C.酸、碱、盐之间发生的反应均属于复分解反应
D.混合物、分散系、胶体从属关系如图所示
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH  B.分别在两种溶液中滴加甲基橙
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别 D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:________________________ 。
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
T ℃下的溶液中,c(H+)=1.0×10-xmol·L-1,c(OH-)=1.0×10-ymol·L-1,x与y的关系如图所示。下列说法不正确的是( )
 A.T ℃时,水的离子积Kw为1×10-13
A.T ℃时,水的离子积Kw为1×10-13
B.T>25
C.T ℃时,pH=7的溶液显碱性
D.T ℃时,pH=12的苛性钠溶液与pH=1的稀硫酸等体积混合,溶液的pH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com