
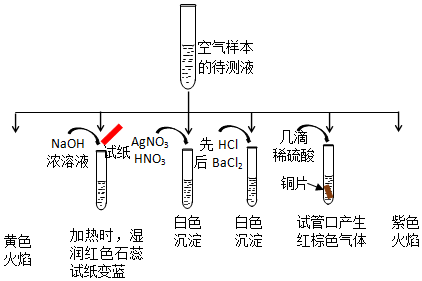

分析 (1)①含有钠离子的物质焰色反应为黄色,含有钾离子的物质透过钴玻璃焰色反应呈现紫色;铵根离子可以和强碱共热反应产生氨气,能使石蕊试纸变蓝;金属铜可以和硝酸反应产生硝酸铜、一氧化氮和水,一氧化氮遇到空气迅速变为红棕色,硝酸银中的银离子可以和氯离子之间反应生成氯化银白色沉淀,硫酸根离子可以和钡离子反应产生白色不溶于盐酸的沉淀,据此回答;
②金属铜可以和硝酸反应产生硝酸铜、一氧化氮和水,一氧化氮遇到空气迅速变为红棕色;
③根据亚硫酸根离子具有还原性,可以和硝酸之间反应得到硫酸根离子来回答;
(2)a.PM2.5是指大气中直径小于或等于2.5μm的颗粒物.它的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物;
b.PM2.5表面积大,具有吸附性,能吸附大量有毒物质;
c.胶体微粒直径在10-7m~10-9m之间,PM2.5粒子的大小不符合;
d.减少机动车尾气排放,减少了烟尘,能降低空气中PM2.5;
(3)①尾气中SO2与氧气和石灰乳反应生成CaSO4和水;
②尾气中NO、NO2与石灰乳反应生成Ca(NO2)2和水,结合氧化还原反应的特征书写.
解答 解:(1)①物质焰色反应为黄色,所以含有钠离子,和强碱共热反应产生氨气,能使石蕊试纸变蓝,证明含有铵根离子,加入硝酸酸化的硝酸银会产生白色沉淀,证明含有氯离子或是亚硫酸根离子中的一种,先加盐酸再加入氯化钡,产生白色沉淀,证明含有硫酸根离子,溶液中加入几滴硫酸,再加入金属铜,可以产生红棕色的气体,证明原溶液含有硝酸根离子,透过钴玻璃观察焰色反应呈现紫色,证明含钾离子,一定含有的钾离子是Na+、NH4+、K+,
故答案为:Na+、NH4+、K+;
②溶液中加入几滴硫酸,再加入金属铜,可以产生红棕色的气体,证明原溶液含有硝酸根离子,金属铜可以和硝酸反应产生硝酸铜、一氧化氮和水,一氧化氮遇到空气迅速变为红棕色,即:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+O2=2NO2,故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+O2=2NO2;
③根据该实验不能确定样本中含有SO32-,加入硝酸酸化的硝酸银会产生白色沉淀,证明可能含有氯离子或是亚硫酸根离子中的一种,亚硫酸根离子可以和硝酸之间反应得到硫酸根离子,亚硫酸根离子可以使高锰酸钾褪色,但是硫酸根离子不能,可以采用高锰酸钾检验亚硫酸根离子的存在,故答案为:否;酸性高锰酸钾溶液;
(2)a.PM2.5是指大气中直径小于或等于2.5μm的颗粒物.它的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,故a正确;
b.PM2.5表面积大,具有吸附性,能吸附大量有毒物质,故b错误;
c.胶体微粒直径在10-7m~10-9m之间,PM2.5粒子的大小不符合,故c错误;
d.减少机动车尾气排放,减少了烟尘,能降低空气中PM2.5,故d正确;
故选:bc;
(3)①尾气中SO2与氧气和石灰乳反应生成CaSO4和水,反应方程式为:2SO2+O2+2Ca(OH)2═2CaSO4+2H2O故答案为:2SO2+O2+2Ca(OH)2═2CaSO4+2H2O;
②尾气中NO、NO2与石灰乳反应生成Ca(NO2)2和水,反应方程式为NO+NO2+Ca(OH)2═Ca(NO2)2+H2O;故答案为:NO+NO2+Ca(OH)2═Ca(NO2)2+H2O.
点评 本题考查了学生离子的检验知识,PM2.5、酸雨的形成、硫氮尾气的应用,注意离子伴随的特征离子反应是解题的关键,难度中等,抓好基础是关键.


科目:高中化学 来源: 题型:解答题
 CO2和CH4是两种主要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究目标.
CO2和CH4是两种主要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究目标.| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2009年10月15日新华社报道:全国农村应当在“绿色生态•美丽多彩•低碳节能•循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:
2009年10月15日新华社报道:全国农村应当在“绿色生态•美丽多彩•低碳节能•循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
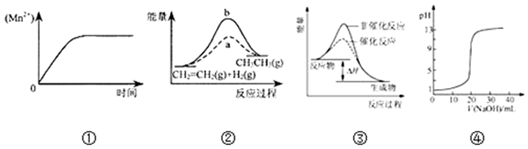
| A. | 图①表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混 合时,n(Mn2+) 随时间的变化 | |
| B. | 图②中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 | |
| C. | 图③表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| D. | 图④表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得到的滴定曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分类标准 | 能导电的物质 | 电解质 | 非电解质 |
| 属于该类的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(HCO3-)>c(H2CO3) | B. | c(OH-)=2c(H+) | ||
| C. | c(Na+)=2c(CO32-) | D. | c(Na+)<c(CO32-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质的水溶液一定比弱电解质溶液的导电能力强 | |
| B. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| C. | 强电解质的水溶液中不存在溶质分子 | |
| D. | 不溶性盐都是弱电解质,可溶性盐都是强电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com