
室温下,水溶液体系中的化学反应I— + OCl— = OI— + Cl—的反应物初始浓度、溶液中的OH—初始浓度及初始速率间的关系如下表所示:
| 实验 编号 | I—的初始浓度 (mol·L-1) | OCl—的初始浓度 (mol·L-1) | OH—的初始浓度 (mol·L-1) | 初始速率v (mol·L-1· s-1) |
| 1 | 2 × 10–3 | 1.5 × 10–3 | 1.00 | 1.8 × 10–4 |
| 2 | a | 1.5 × 10–3 | 1.00 | 3.6 × 10–4 |
| 3 | 2 × 10–3 | 3 × 10–3 | 2.00 | 1.8 × 10–4 |
| 4 | 4 × 10–3 | 3 × 10–3 | 1.00 | 7.2  × 10–4 × 10–4 |
 知表中初始反应速率与有关离子浓度关系可以表示为v=" k" [I—]1 [OCl—]b [OH—]c(温度一定时,k为常数)。
知表中初始反应速率与有关离子浓度关系可以表示为v=" k" [I—]1 [OCl—]b [OH—]c(温度一定时,k为常数)。 = ;
= ;科目:高中化学 来源: 题型:阅读理解
| X |
| X |
| H2O |
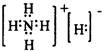
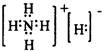
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省龙岩市高三上学期期末化学卷 题型:填空题
室温下,水溶液体系中的化学反应I— + OCl— = OI— + Cl—的反应物初始浓度、溶液中的OH—初始浓度及初始速率间的关系如下表所示:
|
实验 编号 |
I—的初始浓度 (mol·L-1) |
OCl—的初始浓度 (mol·L-1) |
OH—的初始浓度 (mol·L-1) |
初始速率v (mol·L-1· s-1) |
|
1 |
2 × 10–3 |
1.5 × 10–3 |
1.00 |
1.8 × 10–4 |
|
2 |
a |
1.5 × 10–3 |
1.00 |
3.6 × 10–4 |
|
3 |
2 × 10–3 |
3 × 10–3 |
2.00 |
1.8 × 10–4 |
|
4 |
4 × 10–3 |
3 × 10–3 |
1.00 |
7.2× 10–4 |
已知表中初始反应速率与有关离子浓度关系可以表示为v= k [I—]1 [OCl—]b [OH—]c(温度一定时,k为常数)。
(1)为开展实验1,某同学取5mL0.02mol·L-1碘化钾溶液、5mL0.015 mol·L-1次氯酸钠溶液、40mL某浓度氢氧化钠溶液混合反应。则该氢氧化钠溶液物质的量浓度为 ;
(2)实验2中,a= ;
(3)设计实验2和实验4的目的是 ;
(4)计算b、c值:b= ;c= ;
(5)若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,水溶液体系中的化学反应I— + OCl— = OI— + Cl—的反应物初始浓度、溶液中的OH—初始浓度及初始速率间的关系如下表所示:
| 实验 编号 | I—的初始浓度 (mol·L-1) | OCl—的初始浓度 (mol·L-1) | OH—的初始浓度 (mol·L-1) | 初始速率v (mol·L-1· s-1) |
| 1 | 2 × 10–3 | 1.5 × 10–3 | 1.00 | 1.8 × 10–4 |
| 2 | a | 1.5 × 10–3 | 1.00 | 3.6 × 10–4 |
| 3 | 2 × 10–3 | 3 × 10–3 | 2.00 | 1.8 × 10–4 |
| 4 | 4 × 10–3 | 3 × 10–3 | 1.00 | 7.2 × 10–4 |
已知表中初始反应速率与有关离子浓度关系可以表示为v= k [I—??]1 [OCl—]b [OH—]c(温度一定时,k为常数)。
(1)为开展实验1,某同学取5mL0.02mol·L-1碘化钾溶液、5mL0.015 mol·L-1次氯酸钠溶液、40mL某浓度氢氧化钠溶液混合反应。则该氢氧化钠溶液物质的量浓度为 ;
(2)实验2中,a= ;
(3)设计实验2和实验4的目的是 ;
(4)计算b、c值:b= ;c= ;
(5)若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,水溶液体系中的化学反应I— + OCl— = OI— + Cl—的反应物初始浓度、溶液中的OH—初始浓度及初始速率间的关系如下表所示:
| 实验 编号 | I—的初始浓度 (mol·L-1) | OCl—的初始浓度 (mol·L-1) | OH—的初始浓度 (mol·L-1) | 初始速率v (mol·L-1· s-1) |
| 1 | 2 × 10–3 | 1.5 × 10–3 | 1.00 | 1.8 × 10–4 |
| 2 | a | 1.5 × 10–3 | 1.00 | 3.6 × 10–4 |
| 3 | 2 × 10–3 | 3 × 10–3 | 2.00 | 1.8 × 10–4 |
| 4 | 4 × 10–3 | 3 × 10–3 | 1.00 | 7.2× 10–4 |
已知表中初始反应速率与有关离子浓度关系可以表示为v= k [I—]1 [OCl—]b[OH—]c(温度一定时,k为常数)。
(1)为开展实验1,某同学取5mL0.02mol·L-1碘化钾溶液、5mL0.015 mol·L-1次氯酸钠溶液、40mL某浓度氢氧化钠溶液混合反应。则该氢氧化钠溶液物质的量浓度为 ;
(2)实验2中,a= ;
(3)设计实验2和实验4的目的是 ;
(4)计算b、c值:b= ;c= ;
(5)若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com